что хорошо растворяется в воде
Урок №32. Вода — растворитель. Растворы.
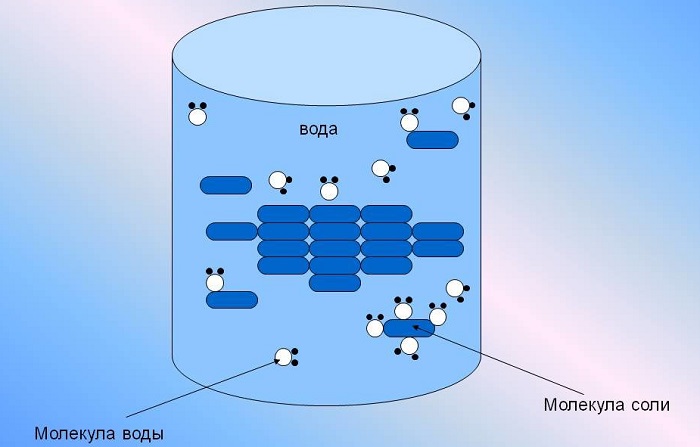
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы по агрегатному состоянию бывают жидкие (раствор соли, кровь), твердые (сплавы металлов) и газообразные (воздух).
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов (растворы с электропроводимостью). В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
По способности растворяться вещества условно делят на:
малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
растворимые (больше 1 г растворенного вещества на 100 г растворителя);
нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
При попадании в воду вещество может:
1. раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
2. химически прореагировать с водой;
3. не раствориться в воде и химически не прореагировать.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Физический – разрушение структуры растворяемого вещества
Химический – образование гидратов (сольватов, если растворитель не вода), вследствие взаимодействия молекул растворителя с частицами растворённого вещества).
Если на разрушение кристаллической решётки затрачивается больше энергии, чем выделяется при образовании гидратов, то растворение сопровождается охлаждением раствора (NH 4 NO 3 ; KNO 3 ), а если меньше – нагреванием (приготовление растворов щелочей, кислот).
Растворение газов и жидкостей не сопровождается разрушением кристаллической решётки, поэтому такие процессы растворения всегда экзотермические.
Тепловые эффекты растворения подавляющего большинства веществ незначительны, потому не заметны.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
Попробуйте сами определить растворимость веществ (см. Таблица растворимости солей, кислот и оснований в воде).
Растворимость веществ
По растворимости в воде все вещества делятся на три группы:
1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые.
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
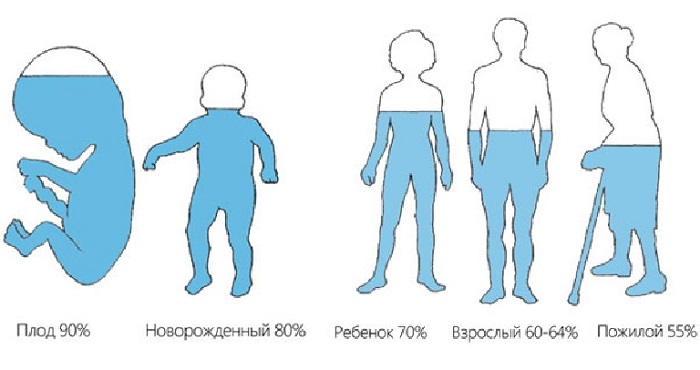
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Контрактное производство
Косметических средств, БАД к пище, фасовка пищевой продукции.
Растворимость
Главным растворителем является вода. Но не все вещества, особенно органические, растворяются в воде. Для растворения используют различные растворители, такие как ацетон, спирт, бензол, эфир, хлороформ, метанол и т.д. Применяются также смеси растворителей, например, смеси спирта с водой.
Чтобы растворить твердое вещество, его следует очень мелко измельчить (истереть вступке или помолоть в мельнице). Это делается для того, чтобы увеличить поверхность соприкосновения растворяемого вещества и растворителя. При перемешивании или взбалтывании ускоряется процесс получения раствора. Часто на емкость, в которой готовится раствор, надевают обратный холодильник. Его используют в основном для приготовления растворов путем кипячения. Этим уменьшают потери растворителя. Образующиеся при нагреваниипары смеси осаждаются в холодильнике и стекают обратно. Особенно это важно для горючих растворителей, пары которых из открытого сосуда могли бы загореться от соприкосновения с нагревающим элементом.
Растворимость веществ бывает:
(Примеры: вода и спирт; калия хлорид и калия бромид; калий и рубидий) – эти вещества смешиваются в любых соотношениях.
По степени растворимости все вещества делятся:
Хорошо растворимым считается вещество, если более 10 г его хорошо растворяется в 100 г воды.
Малорастворимым называют вещество, если в 100 г воды его растворяется менее 1 г.
И нерастворимые – это такие вещества, менее 0,01 г которых переходит в раствор.
Совсем нерастворимых веществ не бывает. Даже когда воду наливают в стеклянный сосуд, то незначительная часть молекул стекла переходит в раствор.
Что дает нам знание о растворимости веществ в производстве косметики? Существует множество вариантов композиций косметических продуктов. Чтобы предотвратить потенциальную несовместимость компонентов в них, для этого и необходимы знания о растворимости веществ. Зная, как и в чем растворяются вещества, подбирают правильный, последовательный ввод в реактор всех необходимых компонентов при изготовлении косметических средств. Понятие «растворимость» широко используется и в фармакологии. По определению растворимости судят о чистоте субстанции и вспомогательных веществ.
При изготовлении лекарственных средств, биологически активных добавок (БАД) зная о растворимости, применяют специальные технологические приемы:
Зная о растворимости веществ, подбирают различные сорастворители, солюбилизаторы и стабилизаторы для создания прочных лекарственных форм.
растворимости веществ в разных растворителях обычно приводятся в частных статьях на субстанции или вспомогательные вещества.
Под растворимостью веществ в фармакопее подразумевают условные термины, которые приведены в таблице № 1(1):
Таблица №1:
Очень важны для приема лекарственных средств и БАД знания о растворимости препарата. Лекарственное средство легче проникает в растворенном виде в желудочно – кишечный тракт, таким образом, принося более быстрый эффект облегчения больному, в отличие от мало растворимых или трудно растворимых лекарственных форм.
Как определяется растворимость веществ?
Берется навеска исследуемого вещества, помещается в отмеренное количество растворителя, раствор встряхивается в течение 10 мин.
Все определения проводят при температуре (18-22) 0 С.
Для медленно растворимых веществ (время растворения которых более 20 минут) возможно прогревание на водяной бане до 30 0 С.
После энергичного встряхивания в течение двух минут и охлаждения раствора до (18-22) 0 С визуально фиксируют результат.
Для медленно растворимых веществ условия растворимости указываются в частных статьях.
Вещество считается растворившимся, если при рассмотрении раствора в проходящем свете в нем не обнаруживаются частицы.
Если неизвестна растворимость вещества, то методика испытания следующая:
Берут 1 г вещества, прибавляют 1 мл растворителя и проводят испытание, как описано выше. Если вещество полностью растворилось, оно считается растворимым очень легко.
В случае, если растворение произошло не полностью, в этот раствор добавляют 2 мл растворителя и продолжают испытание. Навеска растворилась – считается, что вещество растворимо.
Если растворение прошло не полностью, то в раствор добавляют еще 7 мл растворителя и снова проводят растворение, как описано выше. Если при наблюдении в проходящем свете визуально не наблюдаются частицы, значит растворение прошло. Такое вещество считается умеренно растворимым.
В случае обнаружения нерастворенных частиц навески испытания проводят с 10 мг растертого вещества, добавляя к нему 10 мл растворителя. В том случае, если оно растворилось полностью –вещество считается мало растворимым.
Если растворение прошло не полностью, берут 10 мг растертого вещества, прибавляют к нему 100 мл растворителя и снова проводят испытание, как описано в методике. Вещество полностью растворилось – оно очень мало растворимо.
Для веществ с известной растворимостью, проводят испытания по вышеизложенной методике, но только для крайних значений указанного термина растворимости. Например, если вещество растворимо, то 100 мг его не должно раствориться в 1 мл, но полностью растворяется в 3 мл растворителя.Литература.
Государственная Фармакопея Российской Федерации. Х II издание. Часть 1, Москва, 2007 г, с.92-93.
Химическая реакция растворения
Растворение — что это за процесс
Растворы — однородные (гомогенные) системы, в состав которых входят: растворенные вещества, растворитель и (возможно) продукты химической реакции, протекающей между ними.
Особенностью растворенного вещества является равномерное распределение в объеме вещества, которое играет роль растворителя. Для раствора характерно содержание двух и более компонентов.
Растворитель представляет собой вещество, сохраняющее стабильность агрегатного состояния в процессе растворения.
Когда смешивают вещества с идентичными агрегатными состояниями, к примеру, жидкость с жидкостью, газ с газом, твердый материал с твердым, роль растворителя играет компонент с большим содержанием. Процесс, при котором образуется раствор, определяется особенностью взаимодействия частиц растворителя с частицами растворенного вещества и их природой.
Растворение является физико-химическим процессом, в котором можно наблюдать взаимодействие частиц между собой, что приводит к образованию раствора.
Растворение представляет собой результат взаимодействия молекул вещества, играющего роль растворителя, с частицами растворенного вещества. При растворении твердых веществ наблюдают увеличение энтропии. В процессе растворения газообразных веществ энтропия уменьшается. Растворение сопровождается исчезновением межфазной границы, изменением физических свойств раствора, в том числе плотности, вязкости, в некоторых случаях, окраски.
Когда растворитель и растворенное вещество участвуют в химическом взаимодействии, можно наблюдать изменение химических свойств раствора. В качестве примера можно привести растворение газа хлороводорода в воде, результатом которого является образование жидкой соляной кислоты.
Теплота растворения зависит от природы компонентов раствора.
Например: если растворяются кристаллические вещества с растворимостью, увеличивающейся при повышении температуры, то раствор охлаждается. Это объясняется тем, что раствор обладает большей внутренней энергией по сравнению с аналогичными характеристиками кристаллического вещества и растворителя, взятых по отдельности. Как пример, можно рассмотреть кипяток, в котором происходит растворение сахара. В результате раствор значительно охлаждается.
Основные этапы: физическая и химическая стадия
Этапы растворения кристаллических веществ в водной среде:
Классификация растворов в зависимости от механизма растворения:
Физическим растворением называют процесс разрыва и образования лишь межмолекулярных связей, в том числе, водородных.
Физическое растворение можно наблюдать только в случае определенных веществ, выполняющих роль растворителя и растворенного вещества, не вступающих в химические реакции между собой. К примеру, нафталин растворяется в спирте.
Химическое растворение является видом растворения, которое предполагает разрушение исходных химических связей в процессе химического превращения.
Например: химическое растворение протекает при электрической диссоциации растворяемого вещества.
При растворении имеет место следующая закономерность: подобное хорошо растворяется в подобном. Так, в неполярных растворителях хорошо растворяются неполярные вещества. Полярными растворителями целесообразно растворять полярные вещества. Благодаря исследованиям механизмов растворения, природы растворяемых веществ и растворителей, определяют степень растворимости одного вещества в другом.
Признаки химического взаимодействия при растворении
Физические признаки растворения выражаются в виде диффузии. Процесс заключается в распределении частиц растворенного вещества между молекулами вещества, которое является растворителем. В результате «качества» растворенного вещества проявляются в растворе.
Признаками химических явлений являются:
Когда концентрированная серная кислота растворяется в водной среде, температура раствора значительно повышается. Данное явление нашло практическое применение в «химических грелках».
Процесс растворения нитрата аммония в воде сопровождается сильным поглощением теплоты, что объясняет охлаждение раствора. На данном эффекте основан принцип действия гипотермического пакета, который входит в состав автомобильной аптечки для оказания первой медицинской помощи.
Безводный сульфат меди (II) обладает белой окраской. Когда вещество растворяют в воде, раствор окрашивается в голубой цвет.
В современной науке имеет место теория, объединяющая две точки зрения. Ее называют физико-химической теорией растворов. Предпосылки к данной теории были сформулированы еще в 1906 году Д.И. Менделеевым в учебнике «Основы химии».
Факторы растворимости веществ
Растворимость представляет собой свойство вещества растворяться в каком-либо растворителе.
Мера растворимости при заданных условиях определена содержанием данного вещества в насыщенном растворе. Существует условная классификация веществ в зависимости от их способности растворяться:
Когда вещество контактирует с водной средой, можно получить следующий результат:
Коэффициент растворимости определяется, как отношение массы растворенного вещества к массе растворителя (к примеру, 10 г соли на 100 г воды).
В зависимости от того, какой концентрацией обладает растворенное вещество, растворы условно разделяют на:
Ненасыщенные растворы — это те, в которых концентрация растворенного вещества меньше по сравнению с концентрацией в соответствующем насыщенном растворе. Особенность ненасыщенного раствора заключается в возможности при заданных условиях растворить в нем еще определенное количество растворенного вещества.
Насыщенные растворы представляют собой растворы с максимальной концентрацией растворенного вещества при заданных условиях.
В некоторых случаях нет необходимости создавать специальные условия для приготовления насыщенного раствора. Эксперимент можно поставить в домашних условиях.
При смешивании поваренной соли с водой образуется раствор. Когда смесь становится насыщенной, поваренная соль перестает растворяться в воде, так как достигнута ее максимальная концентрация.
Перенасыщенным раствором называют такой раствор, в котором растворенное вещество находится в концентрации, превышающей его концентрацию в насыщенном растворе.
Излишки растворенного вещества достаточно просто выпадают в виде осадка. Для получения перенасыщенного раствора можно, к примеру, охладить насыщенный раствор, компонентами которого являются поваренная соль и вода. В том случае, когда температура снижается, уменьшается растворимость поваренной соли. В результате получают перенасыщенный раствор.
В зависимости от концентрации растворенного вещества растворы бывают:
Концентрированные растворы являются растворами, для которых характерно относительно высокое содержание растворенного вещества.
Разбавленные растворы представляют собой растворы, в которых растворенное вещество характеризуется относительно низким содержанием.
Подобная классификация является условной и не зависит от деления раствора по насыщенности. Разбавленный раствор может являться насыщенным. Концентрированный раствор не во всех случаях можно отнести к насыщенным растворам.
где m р.в. определяет массу растворенного вещества, г;
m р-ля является массой растворителя, г.
Растворимость некоторых веществ в воде при температуре 20 °C:
Растворимость веществ зависит от нескольких факторов:
Абсолютно нерастворимых веществ не существует. Все вещества лишь условно классифицируют на растворимые, малорастворимые и нерастворимые. Даже такие материалы, как серебро и золото, частично растворяются в воде. С другой стороны, растворимость этих металлов столь мала, что ей допустимо пренебречь.
Растворимость, которой характеризуются твердые вещества, определяется структурой этих веществ, то есть типом кристаллической решетки. К примеру, вещества с металлическими кристаллическими решетками, в том числе железо и медь, отличаются малой растворимостью в воде. Вещества, для которых характерна ионная кристаллическая решетка, обычно хорошо растворяются в воде.
Подобное хорошо растворяется в подобном.
Согласно озвученному правилу, вещества, обладающие связями ионного или ковалентного полярного типа, хорошо растворяются в полярных растворителях. В качестве примера можно привести соли, которые характеризуются хорошей растворимостью в воде. С другой стороны, неполярные вещества в распространенных случаях способны хорошо растворяться в неполярных растворителях.
В большинстве своем соли щелочных металлов и аммония хорошо растворяются в водной среде. Высокой степенью растворимости характеризуются практически все нитраты, нитриты, многие галогениды, за исключением галогенидов серебра, ртути, свинца, таллия, и сульфаты, кроме сульфатов щелочноземельных металлов, серебра и свинца. Сульфиды, фосфаты, карбонаты, некоторые другие соли переходных металлов обладают небольшими показателями растворимости.
Растворимость газообразных веществ в жидких средах определяется их природой. К примеру, в 100 объемах воды при температуре 20 °C можно растворить 2 объема водорода, 3 объема кислорода. При аналогичных условиях в 1 доле воды можно растворить 700 объемов аммиака.
Процесс растворения газообразных веществ в воде, как результат гидратации молекул растворяемого газа, протекает с выделением теплоты. В связи с этим, когда температура повышается, растворимость газообразных веществ снижается.
Температурный режим неодинаково влияет на способность твердых веществ растворяться в воде. В распространенных случаях можно наблюдать повышение растворимости при нагреве твердых веществ.
Растворимость твердых и жидких веществ в жидких средах почти не меняется при перепадах давления. Это связано с незначительным изменением объема в процессе растворения. Когда в жидкости растворяют газы, объем системы уменьшается. В связи с этим, при повышении давления увеличивается растворимость газообразных веществ. Общий вид зависимости растворимости газов от давления описан законом У. Генри (Англия, 1803 г.).
Закон У. Генри: растворимость газа при стабильной температуре прямо пропорциональна его давлению над жидкостью.
Рассмотренная закономерность справедлива для небольших давлений в случае газообразных веществ со сравнительно небольшой растворимостью и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителя.
В том случае, когда вода содержит примеси других веществ, например, соли, кислоты и щелочи, газы хуже растворяются в такой среде. Газообразный хлор характеризуется растворимостью в насыщенном водном растворе поваренной соли, которая в 10 раз меньше по сравнению с аналогичным показателем в чистой воде.
Эффект, предполагающий снижение растворимости в присутствии солей, называют высаливанием. Ухудшение свойств растворимости связано с гидратацией солей, которая является причиной уменьшения количества свободных молекул воды. Молекулы воды, образовавшие связи с ионами электролита, не являются растворителем для каких-либо веществ.
Примеры растворения твердых веществ в воде
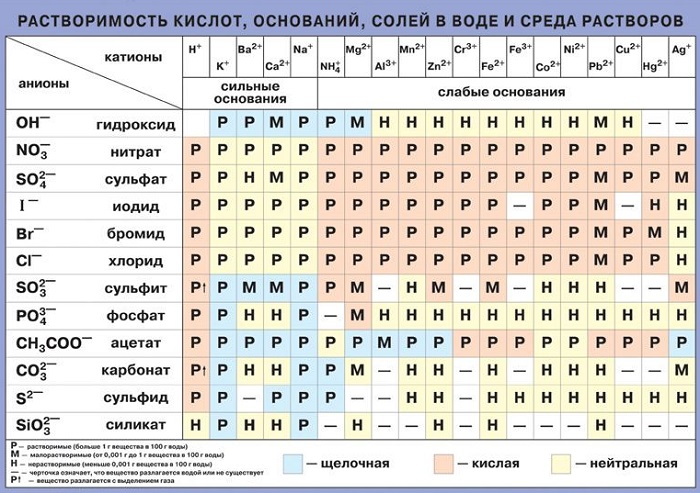
Данные о растворимости веществ необходимы для решения многих задач по химии, связанных с записью уравнений реакций. Таблица растворимости содержит информацию о зарядах веществ, которую используют для корректной записи реагентов и схем химического взаимодействия. По растворимости в воде определяют способность соли или основания диссоциировать.
Водные соединения, проводящие ток, являются сильными электролитами. Существует и другой тип веществ, которые отличаются тем, что плохо проводят ток. Такие соединения являются слабыми электролитами. Сильные электролиты представляет собой вещества, практически полностью ионизирующиеся в воде. В отличие от них, слабые электролиты проявляют это свойство лишь в малой степени.
Существует несколько видов уравнений:
Краткие ионные уравнения являются сокращенным вариантом полных ионных уравнений. В полном уравнении принято записывать все ионы из которых состоят реагенты и продукты реакции.
В виде отдельных ионов можно записывать только сильные электролиты.
Затем, сократив одинаковые ионы, присутствующие в обоих частях химического уравнения, получают уравнение в кратком виде.
В молекулярных уравнениях все, без исключения, вещества записаны в молекулярном виде.