что лучше хумира или энбрел
Современные подходы к терапии ревматоидного артрита
Ревматоидный артрит – хроническое иммуноопосредованное системное воспалительное заболевание соединительной ткани. Оно встречается примерно у 1% от общей численности населения. Болезнь развивается в любом возрасте, но чаще всего в период 45–60 лет. Женщины заболевают ревматоидным артритом примерно в 3 раза чаще, чем мужчины. В России им страдает примерно 300 000 человек. В Юсуповской больницы созданы все условия для лечения пациентов, страдающих ревматоидным артритом:
Развитие и прогрессирование патологического процесса в суставах происходит в течение первых лет болезни. Современная стратегия лечения ревматоидного артрита предусматривает как можно более раннее назначение базисных противовоспалительных препаратов в максимально эффективных и переносимых дозах. При безусловной эффективности подобной терапии количество и тяжесть побочных проявлений порой превосходят выраженность терапевтического эффекта. Даже своевременное назначение базисной терапии не всегда позволяет замедлить прогрессирование деструктивного процесса в суставах.
Препарат хумира является инновационным препаратом выбора при ревматоидном артрите. Ревматологи Юсуповской больницы используют его в качестве монотерапии или в составе комбинированного лечения. Лекарственное средство назначают после комплексного обследования пациента с помощью новейшей аппаратуры и современных лабораторных методов исследования. Тяжёлые случаи заболевания обсуждают на заседании Экспертного Совета с участием докторов и кандидатов медицинских наук, врачей высшей категории. Ведущие специалисты в области ревматологии коллегиально вырабатывают тактику ведения пациентов. Отзывы больных о препарате хумира положительные.
Состав и фармакологическое действие препарата хумира
Лекарственное средство хумира выпускается в стеклянных шприцах, в которых находится одна доза раствора для подкожного введения. Один шприц содержит 40мг основного действующего вещества адалимумаб и вспомогательные ингредиенты:
Раствор лекарственного средства хумира слегка окрашен, опалесцирующий. Препарат оказывает иммунодепрессивное действие. Адалимумаб представляет собой рекомбинантное моноклональное антитело, пептидная последовательность которого идентична lgG1 человека. Он селективно связывается с фактором некроза опухоли, который играет важную роль в развитии патологического воспаления и разрушения суставной ткани, и нейтрализует его биологические функции.
У пациентов, страдающих ревматоидным артритом, препарат хумира вызывает быстрое снижение уровней острофазных показателей воспаления (скорости оседания эритроцитов, С-реактивного белка) и сывороточных уровней цитокинов. После введения препарата отмечается снижение сывороточной активности матриксных металлопротеиназ, вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща.
Показания и противопоказания к применению препарата хумира
Ревматологи Юсуповской больницы назначают препарат хумира пациентам, страдающим следующими заболеваниями:
В первых двух случаях хумира применяется в режиме монотерапии или в сочетании с метотрексатом или иными базисными противовоспалительными препаратами. Отзывы при псориазе хорошие.
Противопоказанием к применению лекарственного средства хумира является повышенная чувствительность к адалимумабу или любым вспомогательным компонентам лекарственного средства, инфекционные заболевания, в том числе туберкулёз, беременность и период грудного вскармливания. Препарат не назначают детям и подросткам до 16 лет. С осторожностью препарат при демиелинизирующих заболеваниях. Врачи рекомендуют женщинам репродуктивного возраста избегать зачатия во время лечения хумирой. Если существует необходимость в лечении препаратом хумира женщин, которые кормят грудью, на время всего курса терапии малыша переводят на искусственное вскармливание.
Побочные эффекты препарата хумира
Во время проведения клинических исследований по безопасности применения препарата хумира установлено, что во время лечения лекарственным средством у пациентов очень часто возникали инфекционные заболевания верхних дыхательных путей. Часто развивалась инфекция нижних дыхательных путей, включая бронхит и пневмонию, органов мочевыделительной системы, герпетическая инфекция (включая простой и опоясывающий герпес). При применении препарата хумира у пациентов повышается риск заболевания гриппом, поверхностной грибковой инфекцией, включая поражения кожи и ногтей.
Возможны следующие осложнения со стороны системы кроветворения:
Иногда у пациентов увеличиваются лимфатические узлы. Редко возникают реакции повышенной чувствительности. При применении препарата хумира нечасто развиваются нежелательные реакции со стороны обмена веществ: гиперхолестеринемия, гиперурикемия, снижение аппетита, анорексия, гипергликемия, снижение или повышение массы тела.
У некоторых пациентов возникают реакции со стороны следующих систем организма:
У пациентов во время лечения препаратом хумира может возникнуть сыпь на коже, кожный зуд, выпадение волос. Редко возникают язвы на коже, ангионевротический отёк, шелушение кожи, реакции фотосенсибилизации. Пациентов может беспокоить боль в суставах, мышцах, плечевом поясе и спине. Редко возникают мышечные судороги, бурсит, синовит, тендинит. Со стороны мочеполовой системы возможны следующие нежелательные реакции:
У женщин может нарушиться менструальный цикл. Иногда у пациентов повышается утомляемость, повышается температура тела. Их беспокоит чувство жара, озноб, боль в грудной клетке. Может ухудшаться заживление ран.
Способ применения и дозы препарата хумира
Подкожную инъекцию препарата хумира выполняют в область живота или передней поверхности бедра. Перед введением осматривают раствор на предмет изменения цвета и наличия посторонних частиц. При ревматоидном, псориатическом артрите и анкилозирующем спондилите хумиру назначают по 40 мг 1 раз в две недели. При назначении хумиры продолжают терапию глюкокортикостероидами, нестероидными противовоспалительными средствами, метотрексатом, анальгетиками, салицилатами.
У некоторых пациентов, которые не получают метотрексат, дополнительный эффект достигают при увеличении кратности применения препарата хумира до 40 мг 1 раз в неделю.
Лекарственное средство хумира не смешивают в одном шприце в одном шприце или флаконе с любыми другими препаратами. Остатки раствора и использованные материалы уничтожают. Перед выполнением инъекции хумиры достают из упаковки и кладут на чистую поверхность один шприц с хумирой и одну салфетку, пропитанную спиртом салфетку. Медицинский персонал перед выполнением инъекции убеждается, что не истёк срок хранения препарата, указанный на шприце.
Выбирают место для инъекции на передней поверхности бедра или животе. Места инъекций и стороны меняют. При выполнении каждого последующего введения отступают от предыдущего на 2 сантиметра. Нельзя вводить препарат в место, где определяется уплотнение или подкожная гематома, есть покраснение кожи. Место инъекции обрабатывают круговыми движениями спиртовой салфеткой.
Снимают колпачок с иглы, одной рукой собирают в складку обработанную кожу, в другую руку берут шприц, держа его градуированной поверхностью вверх, под углом 45° к поверхности кожи. Быстрым движением полностью вводят иглу в кожную складку. После введения иглы складку кожи отпускают. Весь раствор вводят в течение 2–5 секунд. Когда шприц будет пустым, вынимают иглу из кожи, под тем же углом. Слегка прижимают кусочком марли область инъекции в течение 10 секунд, но не трут поверхность. Из места инъекции иногда выделиться небольшое количество крови. При желании можно наложить пластырь.
Препарат хумира хранят в защищённом от света месте, недоступном для детей месте, при температуре от 2 до 8 °C. Срок годности препарата 2 года. По истечении срока годности, указанного на упаковке, медицинский персонал Юсуповской больницы препарат не применяет. Лекарственное средство хумира отпускают из аптек по рецепту врача. Для того чтобы пройти обследование и лечение заболеваний, при которых применяют препарат хумира, записывайтесь на приём к ревматологу, позвонив по телефону контакт центра Юсуповской больницы. Отзывы пациентов о лечении лекарством хумира хорошие.
В лечении болезни Бехтерева значительный прогресс
А.А. ГОДЗЕНКО, доцент кафедры ревматологии РМАПО, кандидат медицинских наук Москва
Анкилозирующий спондилит (АС) — болезнь Бехтерева, болезнь Штрюмпелля—Мари—Бехтерева — это хроническая воспалительная патология, характеризующаяся преимущественным поражением позвоночника (спондилит), крестцово-подвздошных суставов (сакроилеит), во многих случаях периферических суставов (артрит), энтезисов (энтезит), у части больных — глаз (увеит), сердца, аорты и других внутренних органов.
После 40 лет заболевание развивается редко
Как большинство ревматических болезней АС является мультифакториальным заболеванием. Ключевая роль в развитии АС антигена гистосовместимости HLA-В27, выявляющегося у 90% больных, установлена и доказана. Предполагается также триггерная роль ряда инфекционных факторов, в частности, определенных видов кишечной и урогенитальной флоры: хламидий, иерсиний, кампилобактерий, шигеллы, сальмонеллы.
Начало болезни чаще приходится на 3-е десятилетие жизни, может развиваться у детей, после 40 лет начинается редко. Мужчины заболевают в 2—3 раза чаще женщин.
Поражение позвоночника начинается обычно с крестцово-подвздошных суставов и носит восходящий характер, с постепенным вовлечением вышележащих отделов. Отражением воспаления в крестцово-подвздошных суставах — сакроилеита — является перемежающаяся боль в области ягодиц, иногда иррадиирующая в ягодичные складки, по задней поверхности бедра, в паховую область. Боль постепенно нарастает, становится двусторонней и постоянной. Характерной особенностью воспалительной боли является ее уменьшение после приема нестероидных противовоспалительных препаратов (НПВП).
При АС в патологический процесс вовлекаются все отделы позвоночника. Спондилит поясничного отдела проявляется болью в поясничной области и постепенно нарастающей тугоподвижностью. Боль усиливается во второй половине ночи, сопровождается утренней скованностью. Заболевание часто протекает под маской пояснично-крестцового радикулита, в связи с чем диагноз ставится лишь через несколько лет после начала боли в спине.
При поражении грудного отела позвоночника, реберно-позвоночных суставов отмечается боль в грудной клетке, иногда опоясывающая, усиливающаяся при кашле, глубоком вдохе, поворотах туловища. Возможна боль в грудинно-ключичных и грудинно-реберных сочленениях, межреберная невралгия. В результате поражения реберно-позвоночных суставов уменьшается дыхательная экскурсия грудной клетки, что приводит к уменьшению жизненной емкости легких. Дыхательная функция при этом компенсируется за счет диафрагмы
Шейный отдел позвоночника поражается на более поздней стадии заболевания. Вначале появляется боль, постепенно уменьшается диапазон движений шеи: ограничиваются ротация и наклоны. В ряде случаев происходит полный анкилоз шейного отдела позвоночника с абсолютной неподвижностью головы и шеи, что серьезно ограничивает функциональную способность пациента.
Воспалительная боль рефлекторно вызывает мышечный спазм, что способствует развитию тугоподвижности позвоночника. На ранних стадиях болезни ограничение движений в позвоночнике обусловлено воспалением и болевым спазмом мускулатуры спины, на поздних — преимущественно оссификацией позвоночника.
В результате воспалительного поражения позвоночника происходит характерное изменение осанки: сглаженность вначале поясничного, затем шейного лордоза. У многих пациентов формируется кифоз. Если у здоровых людей при наклоне вперед позвоночник образует плавную дугу, то у больных АС спина остается плоской.
Прогноз болезни Бехтерева зависит от поражений сердца
Воспаление энтезисов (энтезит) считается одним из характерных признаков АС. Энтезисом называется место прикрепления связок, апоневрозов, сухожилий и суставных капсул к кости. Энтезиты при АС клинически проявляются болью при определенном движении, в котором участвует соответствующее сухожилие, пальпаторной болезненностью в области энтезиса, иногда — отечностью. Наиболее часто в патологический процесс при АС вовлекаются энтезисы ахиллова сухожилия, подошвенного апоневроза, гребней подвздошных костей, остистого отростка 5позвонка.
Среди внескелетных проявлений АС самым частым является увеит, который отмечается примерно у 20—40% больных. Пациенты испытывают боль в глазу, фотофобию, слезотечение, затуманивание зрения; отмечается также гиперемия конъюнктивы.
Поражение сердца занимает особое место в клинической картине АС, поскольку его наличие определяет прогноз и характер лечебных мероприятий. Описаны следующие кардиологические синдромы при АС:
— Аортит и аортальная недостаточность (АР);
— Нарушение проводимости с развитием атриовентрикулярной (а/в) блокады;
— Вальвулит митрального и аортального клапанов;
Неврологические нарушения при АС чаще всего проявляются радикулярными синдромами различной локализации. Более редкая неврологическая проблема — синдром «конского хвоста», развивающийся вследствие компрессии нервных корешков конечных отделов спинного мозга. При этом нарушается иннервация нижних конечностей и мочевого пузыря, что приводит к нарушению тазовых функций, парезу ног.
Нью-Йоркские критерии Ван Дер Линдена
Специфических лабораторных показателей для диагностики и оценки воспалительной активности АС нет. Отмечается повышение уровня СОЭ и СРБ, однако у части больных эти показатели остаются нормальными или повышены несущественно, что, вероятно, связано с преобладанием процессов фиброза, при которых не происходит ярких клеточных воспалительных реакций, а также поражением суставов хрящевого типа. Определение HLA-В27 имеет диагностическую ценность на ранних стадиях болезни, когда еще нет характерных рентгенологических проявлений. В настоящее время для оценки степени воспалительной активности и функциональных нарушений при АС используются визуально-аналоговые шкалы (ВАШ), определяющие уровень боли и скованности, а также ряд суммарных показателей, характеризующих те или иные параметры заболевания, которые вычисляются на основании опросников.
Рентгенологическое исследование позволяет выявлять только хронические костные изменения, которые являются следствием, но не собственно проявлением воспаления, поэтому малоинформативно на ранних стадиях болезни.
Изменения первично развиваются в кре-стцово-подвздошных суставах, как правило, в течение первого года болезни. Сакроилеит имеет первоочередное значение для диагностики АС. К рентгенологическим признакам сакроилеита относятся субхондральный склероз сочленяющихся костей (подвздошной и крестца), эрозии костной ткани, сужение или псевдорасширение суставной щели. Конечной стадией сакроилеита является анкилоз крестцово-подвздошных суставов.
В последнее десятилетие значительную роль в ранней диагностике, оценке активности и понимании болезни в целом приобрела МРТ крестцово-подвздошных суставов и позвоночника. В частности, при ее помощи можно выявить воспалительный процесс в крестцово-подвздошных суставах и позвоночнике до появления рентгенологических изменений.
До настоящего времени диагноз АС устанавливается на основании Нью-Йоркских критериев (Van der Linden S, 1984 г.):
1) ночная боль и скованность внизу спины длительностью не менее 3-х мес, уменьшающаяся при движениях;
2) уменьшение подвижности в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях;
3) ограничение экскурсии грудной клетки относительно нормы для пола и возраста;
4) двусторонний сакроилеит II—III стадии или односторонний III—IV стадии.
1) клинический критерий + рентгенологический = определенный АС;
2) только клинические или только рентгенологические критерии = вероятный АС.
В лечении достигнут существенный прогресс
В течение последнего десятилетия достигнут существенный прогресс в лечении АС, что связано с внедрением в клиническую практику нового класса лекарственных средств — генно-инженерных биологических препаратов. Применение этих средств позволило существенно улучшить качество жизни пациентов. Тем не менее следует признать, что до настоящего времени неизвестны методы, позволяющие полностью приостановить патологический процесс.
Немедикаментозная терапия АС включает ежедневное выполнение упражнений, направленных на поддержание достаточной амплитуды движений позвоночника, крупных суставов, укрепление мышц спины; дыхательную гимнастику; массаж спины; физиотерапевтические процедуры, бальнеотерапию.
Ведущую роль в терапии АС играют нестероидные противовоспалительные препараты (НПВП), которые показаны всем пациентам. НПВП являются препаратами первой линии при АС и рекомендуются для постоянного продолжительного непрерывного приема. Несмотря на то, что НПВП традиционно рассматриваются как симптоматические сред-ства лечения, имеются данные, позволяющие считать постоянный прием НПВП фактором, положительно влияющим на предотвращение рентгенологических изменений при АС, по сравнению с пациентами, принимающими НПВП «по требованию».
Предпочтение для лечения АС отдается неселективным НПВП — индометацину и диклофенаку, которые назначаются сразу после установления диагноза в полной суточной дозе — до 150 мг в сутки. В случае повышенного риска желудочно-кишечных осложнений целесообразно сочетание НПВП с гастропротекторами или использование селективных ингибиторов ЦОГ-2, например нимесулида. Однако имеющийся на сегодняшний день клинический опыт позволяет считать селективные НПВП менее эффективными при лечении АС по сравнению со стандартными.
Об этом диагнозе можно узнать и случайно
Применение базисных противовоспалительных препаратов (БПВП), включая метотрексат, сульфасалазин, лефлюномид, в настоящее время признано неэффективным при аксиальной форме АС. Основные показания к назначению сульфасалазина — поражение периферических суставов и рецидивирующий увеит. Назначается он в дозе не менее 2 г в сутки. В этих же ситуациях может использоваться метотрексат в дозах 10—15 мг в неделю в случае недостаточной эффективности или непереносимости сульфасалазина.
Инфликсимаб применяется в дозе 3—5 мг/кг веса тела в виде в/в инфузий по стандартному графику: 0—2—6 — далее через 8 недель. Рекомендуемая доза инфликсимаба для лечения АС — 5 мг/кг. Однако применение даже в меньшей дозе — 3 мг/кг — оказалось достаточно эффективным и хорошо переносимым. Адалимумаб назначается в дозе 40 мг 1 раз в 2 недели п/к. Этанерцепт также оказался действенным и относительно безопасным препаратом в терапии АС. Назначается п/к по 25 мг дважды в неделю. Предикторами клинического ответа на ингибиторы ФНО при АС считаются короткая продолжительность болезни, молодой возраст, повышение СОЭ, наличие воспалительных МРТ изменений в позвоночнике.
АС считается в целом более «доброкачественным» заболеванием, чем ревматоидный артрит. Большая часть пациентов с поражением осевого скелета хорошо отвечают на НПВП. Даже при наличии структурных изменений позвоночника многие пациенты сохраняют трудоспособность. Более того в ряде случаев при имеющихся явных рентгенологических изменениях и функциональных нарушениях со стороны осевого скелета пациенты узнают о своем диагнозе случайно, расценивая эпизоды боли в спине как радикулит.
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 2. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 9. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
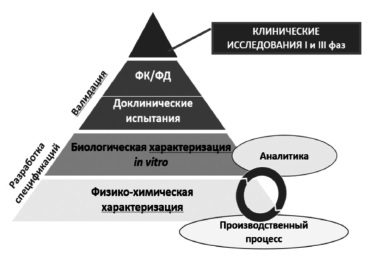
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 17 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.

