что лучше левомеколь или линимент бальзамический по вишневскому
Вросший ноготь – причины, симптомы, способы лечения, профилактика
Что такое вросший ноготь?
При этом заболевании происходит врастание ногтевой пластинки в околоногтевой валик. Чаще всего поражению подвергается большой палец ноги. Заболевание начинается с какого-либо «провоцирующего» момента – травмы при педикюре, ушибе, ношении узкой обуви и др. Возникает отек валика, он плотнее прижимается к ногтевой пластинке и немного травмируется ей (возникает ссадина, микротрещина). Это, в свою очередь, вызывает усиление отека, появление боли. Почти сразу присоединяется инфекция – в ранку внедряются микроорганизмы. Воспалительные явления постепенно прогрессируют – в области околоногтевого валика появляется покраснение, нарастают боль и отек. Между ногтем и валиком начинает выделяться гной, позднее там же появляются гипергрануляции (т.н. «дикое мясо»). До присоединения инфекции врастание ногтя еще может остановить лечение в домашних условиях – оно будет описано ниже. При нагноении, а особенно при появлении «дикого мяса» консервативное лечение всегда неэффективно, оно может приносить лишь кратковременное уменьшение симптомов. Радикально может помочь только хирургическое вмешательство.
Причины врастания – почему это происходит
Чаще всего вросший ноготь (синоним – онихокриптоз) является итогом совокупности нескольких причин.
Непосредственной причиной вросшего ногтя может стать как один из предрасполагающих факторов, так и их сочетание.
Симптомы
Диагностика вросшего ногтя обычно не представляет сложностей. Основной симптом – боль в области околоногтевого валика, сначала при надавливании, а затем и в покое. Быстро присоединяются отек и покраснение. Между валиком и ногтем вскоре начинает выделяться гной. Покраснение нарастает, на фоне применения различных средств может временно уменьшаться, но почти всегда процесс приобретает хронический характер и может длиться месяцами. Для хронизации заболевания характерно появление гипергрануляций («дикого мяса»). В очень редких и запущенных случаях возможен переход воспаления на кость фаланги – остеомиелит.
В общем состоянии пациента изменений обычно не наблюдается. В анализе крови возможно небольшое увеличение количества лейкоцитов при остром воспалении и повышение СОЭ. При длительном врастании необходимо выполнение рентенографии пальца для исключения вовлечения в процесс кости фаланги – остеомиелита.
Методы лечения
Лечение вросшего ногтя на большом пальце ноги проводится разными методами. Основным и самым надежным методом является хирургическое вмешательство. Операция на больших пальцах проводится амбулаторно, госпитализация не требуется. Существует несколько модификаций операций, в т.ч. с применением радиоволны и лазера. Какую именно операцию выполнить данному пациенту, решает врач, в зависимости от конкретной ситуации.
Анестезия при операциях на вросшем ногте всегда проводниковая – в основание пальца с двух сторон под кожу вводится небольшое количество анестетика, после чего необходимо подождать 5 – 10 минут, и наступает полная анестезия пальца. При этом виде анестезии операция совершенно безболезненна в 100% случаев.
Рассмотрим основные виды операций. Все они решают вопрос, как убрать вросший ноготь на ноге.
Краевая резекция ногтевой пластинки с применением радиоволны или лазера.
Этот метод является наиболее распространенным, малотравматичным и надежным, заключается в удалении врастающего края ногтя (1 – 2 мм), обработки фрагмента ростковой зоны радиоволной или лазером, удалении гнойных тканей по краю околоногтевого валика. Следует отметить, что принципиальной разницы между радиоволновым и лазерным воздействием нет, оба этих прибора обеспечивают надежное разрушение нужного фрагмента ростковой зоны при минимальном повреждении соседних тканей.
Преимущества метода
Недостатки метода
При отсутствии в распоряжении хирурга радиоволнового или лазерного прибора выскабливание фрагмента ростковой зоны можно произвести при помощи хирургического инструмента (ложка Фолькмана), но это уменьшает надежность результата.
Краевая резекция ногтевой пластинки с пластикой околоногтевого валика по Шмидену
Метод однозначно показан пациентам с избыточным околоногтевым валиком. Если оставить такой валик, то при всех остальных видах операций он все равно будет являться причиной рецидива. Относительное показание – многократные рецидивы после других вмешательств.
Техника операции: выполняется обычная краевая резекция с применением радиоволны или лазера, которая дополняется клиновидым иссечением околоногтевого валика с закрытием дефекта швами. Швы снимают на 7 – 8 сутки, после чего наступает выздоровление. Рецидивы после операции Шмидена крайне редки.
Преимущества метода
Недостатки метода
Полное удаление ногтевой пластины
В настоящее время этот метод практически не применяется в связи с высокой травматичностью, длительным заживлением раны и отрастанием ногтя, высокой вероятностью рецидива. Применение его возможно в исключительных случаях, по рекомендации дерматолога (миколога), когда ноготь сильно поражен грибком и почти полностью отслоен от ложа, т.е. сохранять его не имеет смысла, а лучше удалить полностью.
Другие методы лечения
Самостоятельное лечение в домашних условиях и народными средствами
Такое лечение допустимо лишь в самых начальных проявлениях врастания, когда имеется лишь небольшая болезненность и отек валика. При нагноении, а тем более, при появлении «дикого мяса», лечение в домашних условиях неэффективно, может принести временное облегчение, но все симптомы вскоре вернутся. В этих случаях нужна операция.
Из «домашних» методов можно порекомендовать полуспиртовые повязки с мазью «левомеколь». На область воспаления накладывают полоску мази «левомеколь», после чего палец оборачивают марлевой салфеткой, пропитанной водкой и фиксируют ее обычным бинтом. Время ношения повязки – до полного высыхания. Можно накладывать два раза в день – утром и на ночь. Если в течение 2-3 дней симптомы не исчезли – нужно обратиться к врачу, который установит, как лечить правильно данное состояние.
Следует предостеречь от использования таких методов, как применение алоэ, чистотела. Эти средства, как и многие похожие на них могут вызывать сильное местное раздражение тканей, и, тем самым, вызвать прогрессирование воспаления. К тому же не исключена аллергическая реакция. Мазь Вишневского создает благоприятные условия для развития микрофлоры, поэтому также не рекомендуется к применению.
Практика показывает, что чаще всего после длительного применения всевозможных «домашних» и «народных» методов, пациенты все равно попадают на операцию, но уже в более «запущенном» состоянии.
Консервативные методы лечения
В основном применяются при неосложненном вросшем ногте, когда нет выраженного нагноения, стойкой инвазии ногтевой пластинки в ткани околоногтевого валика. Известно множество методов консервативного лечения – тампонада, наложение корректирующих устройств (пластиковых металлических, клеящихся на ноготь, в виде одно- и двухсторонних скоб и др.). Во многих случаях лечение всеми этими методами бывает довольно эффективно. Есть и недостатки. К основным из них можно отнести следующие:
Методы профилактики
Для профилактики вросшего ногтя нужно соблюдать несколько правил, которые в большинстве случаев помогают избежать проблем.
Во-первых, нужно носить удобную обувь не с узким носком, каблук дожжен быть высотой не более 4 см.
Во-вторых, необходимо правильно подстригать ноготь – край ногтя должен «выйти» из валика, и только потом можно его закруглять. Таким образом, на валик будет приходиться давление не «угла», а «плоскости», что уменьшит вероятность врастания.
В-третьих, при наличии плоскостопия нужно носить специальные ортопедические стельки.
В-четвертых, при наличии грибка ногтей, его нужно вылечить у дерматолога или миколога.
Где удалить?
Для решения проблемы необходимо обратиться к хирургу. Только этот специалист может избавить от вросшего ногтя. При выборе специалиста нужно руководствоваться его опытом, стажем работы. Полезно будет почитать отзывы о нем других пациентов (их всегда можно найти в интернете). Большое количество негативных отзывов, а также отсутствие отзывов должно насторожить. В клинике, где работает доктор, должна быть необходимая аппаратура для радиоволнового или лазерного удаления. Врач должен иметь достаточный опыт работы на этих аппаратах, т.к. при недостаточном воздействии радиоволны или лазера может быть рецидив, а при избыточном возможно повреждение соседних участков ростковой зоны, что вызовет стойкую деформацию всего ногтя. Хирург, также, должен уметь делать пластику околоногтевого валика, чтобы применить этот метод при наличии соответствующих показаний.
Доктор Ельшанский Игорь Витальевич имеет стаж работы хирургом с 1993 года, к.м.н., занимается лечением вросшего ногтя более 20 лет, владеет всеми методами лечения и модификациями операций. В клинике имеется радиоволновой прибор, есть все условия для диагностики и лечения вросшего ногтя на любых стадиях заболевания.
Левомеколь
Перечисленные свойства проявляются благодаря действию следующих компонентов, входящих в состав мази, — хлорамфениколу и метилурацилу. Хлорамфеникол — антибиотик натурального происхождения. Влияет на регенеративные свойства эпидермиса. Метилурацил быстро и глубоко проникает в кожные покровы, не затрагивая мембраны клеток. При этом активно выводится из межтканевого пространства избыточная лимфа, из-за которой появляется отечность тканей.
Применение мази «Левомеколь»
«Левомеколь» назначается, чтобы решить следующие задачи:
Мазь отлично справляется даже в случае, если у человека уже имеется выраженный воспалительный процесс с присутствием гноя.
Показания к назначению
В первую очередь мазь обладает антибактериальными свойствами и уменьшает воспалительный процесс, поэтому используется при следующих патологических состояниях:
«Левомеколь» допускается использовать в детском возрасте после предварительной консультации врача. Мазь подходит для лечения незажившей пупочной ранки. Ее можно наносить на место укусов насекомых.
Противопоказания к применению
Помимо показаний, существуют и противопоказания, к которым относят:
Побочные эффекты
Несмотря на то что «Левомеколь» — универсальный препарат и хорошо переносится, в некоторых случаях при наличии определенных заболеваний принимать его следует с осторожностью или вообще исключить. Поскольку могут проявляться побочные эффекты в виде:
«Левомеколь» следует с осторожностью сочетать с другими препаратами — бальзамами, болтушками, порошками. Одновременно смешивать с другими мазями не рекомендуется. Важно, чтобы средство не попало на слизистые оболочки внутренних органов, например желудка, а также глаз, носа. При проглатывании следует промыть желудок. Если средство попало на слизистые оболочки глаз, то рекомендовано обработать их проточной водой.
«Левомеколь» при беременности и в период лактации
Мазь при нанесении на кожу не попадает в системный кровоток, поэтому не оказывает влияния на функционирование внутренних органов. Ее разрешено использовать при беременности, а также в период лактации. Однако все равно необходима консультация врача.
Мазь при лечении ожогов
«Левомеколь» помогает быстрее затянуться ране, уничтожить микроорганизмы, ускорить репаративные процессы.
При лечении ожогов 1 и 2 степени рекомендуется выполнять следующие действия:
Ожоговая поверхность обрабатывается до полного восстановления кожных покровов. Курс лечения в среднем составляет 7—14 дней.
«Левомеколь» при лечении угревой сыпи
Мазь может прекрасно помочь в лечении прыщей. Даже если они наполнены гнойным содержимым или имеются некротизированные ткани. Способ лечения во многом зависит от выраженности патологического процесса и количества элементов. Однако мазь не используется, если инфицирование связано с грибковой инфекцией.
При мелких высыпаниях средство наносится тонким слоем на несколько часов. Как правило, это делается вечером, непосредственно перед сном мазь должна быть удалена. В течение нескольких недель прыщи исчезают и устраняются мелкие рубчики.
Средство при лечении геморроя
«Левомеколь» может назначаться и при геморрое, но только в составе комплексного лечения, когда происходит обострение заболевания. Препарат эффективен, если к кровоизлиянию и трещинам присоединилась инфекция бактериальной природы. После нанесения удается уменьшить воспаление и бактериальную нагрузку, восстановить регенерацию тканей анального отверстия.
Прежде чем использовать средство, необходимо придерживаться следующих рекомендаций:
Лечение составляет в среднем 7—10 дней. Препарат не является специализированным в лечении геморроя. При устранении воспаления необходима консультация врача, который сориентирует в дальнейших действиях.
Мазь при лечении ран
С помощью мази «Левомеколь» удается предотвратить распространение инфекционного процесса за пределы раны, сократить период восстановления.
Как правильно использовать мазь:
Как правило, обработка проводится всего лишь раз в день.
Если рана гнойная, что заметно по характерным выделениям, то первым делом она обрабатывается антисептическим препаратом. После этого в рану закладывается мазь, которая не должна слишком плотно ее заполнять. Сверху накладывается марлевая салфетка и фиксирующий бинт. Частота смены повязки зависит от количества гноя, который выделяется.
Если гнойная рана глубокая, то мазь предварительно нагревается. Ею пропитывают стерильные тампоны, которые вводятся рыхло. Врач может вводить мазь через дренажные трубки. В среднем лечение составляет до 10 дней.
«Левомеколь» в гинекологии
Мазь успешно применяется для лечения урогенитальных инфекций. В гинекологической практике она доставляется к патологическому очагу с помощью тампонов, которые должны быть предварительно ею пропитаны.
Подобный способ применяется для лечения патологий, перечисленных ниже:
Лечение представляет собой следующую последовательность:
В урологии мазь назначается для лечения воспаления крайней плоти. Манипуляция заключается в следующих действиях:
Процедуру следует выполнять несколько раз в сутки.
Какая мазь лучше: Вишневского или «Левомеколь»?
Эти два лекарственных средства с разными свойствами. Мазь Вишневского уничтожает микроорганизмы, ускоряет репаративные процессы, но отличается по своему составу, механизму влияния на микробы. Назначается, когда раневая поверхность пребывает в процессе восстановления и регенерации (то есть не с самого начала повреждения тканей). Ее не рекомендуется наносить при остром воспалении. Несмотря на то что препарат содержит антисептик, его содержания недостаточно. Входящее в состав касторовое масло улучшает питание тканей и лишь усугубляет ситуацию.
«Левомеколь» содержит антибактериальные вещества, которые эффективны в самом начале воспаления. Кроме того, у мази имеются явные преимущества — отсутствие неприятного запаха, лучшие репаративные свойства, отсутствие раздражения в области обработки, быстрое вскрытие нарыва и последующее заживление раны.
Аналоги препарата
Существуют препараты, которые напоминают по своему действию «Левомеколь». Они также обладают ранозаживляющим и бактерицидным эффектом. Разница заключается в основных компонентах. К похожим препаратам относятся:
Перечисленные медикаменты могут быть использованы вместо мази «Левомеколь» только после назначения врача.
Имеются противопоказания. Перед применением проконсультируйтесь со специалистом.
Перед применением препаратов, указанных на сайте, проконсультируйтесь с врачом.
ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
 |
| Рис. 1 |
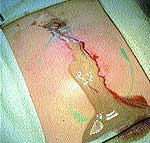
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
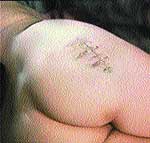 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Выбор антисептиков, используемых для промывания ран
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
Возможности использования мазей
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
Аэрозоли
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
Масла
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Раневые покрытия
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
Гидроколлоиды
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Гентацикол
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.