что лучше маалокс или де нол
Препараты для желудка
Пищеварение — сложный физиологический процесс. Желудок играет в нем важнейшую роль: он секретирует пищеварительный сок, собирает токсины, расщепляет белки на аминокислоты и т.д. Когда пищеварение нарушается, не стоит бесконтрольно принимать лекарства для желудка. Важно запомнить как и в каких ситуациях проявляются неприятные ощущения, чтобы дать лечащему врачу точную информацию для правильного назначения терапии.
Распространенные причины проблем с желудком
Чтобы выбрать эффективный и действенный препарат для желудка, нужно определить происхождение проблемы. Это могут быть:
острые состояния, с которыми не справиться без медицинской помощи;
незначительные временные нарушения.
При более детальном рассмотрении проблемы можно выделить пять основных причин.
Неправильное питание
Употребление продуктов сомнительного качества, фаст-фуд и несбалансированный рацион могут провоцировать периодические спазмы. При переедании образуется внутреннее давление, провоцирующее изжогу. Регулярное употребление в пищу бобовых приводит к газообразованию. Пища с высоким содержанием токсинов (бахчевые, плодовые) может вызывать отравления организма различной степени тяжести.
Воздействие стресса
Стрессовые факторы могут провоцировать острые и неожиданные спазмы в области желудка. Причиной выступают экстремальные ситуации, а не хронические и затянувшиеся депрессии. В таких ситуациях рекомендуется принять травяной успокаивающий чай, спазмолитик.
Антибиотикотерапия
Любые лекарственные средства, принимаемые длительный период, оказывают на человека положительное и одновременно негативное действие. Даже если терапия проводится не в отношении ЖКТ, именно он в первую очередь страдает от побочных действий. Антибиотики перорального типа поступают в желудок, где они и разделяются на отдельные компоненты, распространяющиеся по назначению.
В результате нарушается микрофлора пищеварительной системы, из-за чего появляются неприятные ощущения. Наиболее выраженное побочное действие у цефалоспорина и тетрациклина. Даже при сокращенном курсе лечения они:
уничтожают полезную микрофлору;
провоцируют дисбаланс рН.
Помощь в таких случаях оказывается пробиотиками. Также можно привести в норму желудочную кислотность, регулярного употребляя кисломолочные продукты.
Язвенная болезнь
Язва кишечника или желудка возникает по таким причинам, как:
стрессы хронического типа;
поступление в ЖКТ агрессивных химических компонентов.
В хроническом состоянии боль практически неощутима. Она прогрессирует в периоды обострения после употребления кислых или острых продуктов, алкоголя, различных пряностей. В критических случаях острая боль может сопровождаться внутренним кровотечением.
Гастрит
Это воспалительный процесс, который поражает слизистую оболочку желудка. Заболевание бывает хроническим с регулярным болевым синдромом или острым с резкими приступами, быстро появляющимися и исчезающими. Лечение гастрита рекомендуется начинать на самых ранних стадиях.
Лекарственные средства при язве и гастрите
Терапия этих заболеваний должна назначаться врачом, с учетом имеющейся симптоматики. Эти патологии взаимосвязаны, поэтому препараты для их лечения схожи. Чаще всего их действие направлено на нейтрализацию H. Pylori. Таблетки, назначаемые при боли в животе, можно условно разделить на 4 категории.
Антибиотики
Гастроэнтерологи тщательно подходят к подбору лечения антибиотиками. Необходимо сопоставить риски побочных действий и полезный эффект. Чаще всего двухнедельный курс антибиотикотерапии — это единственный способ уничтожить H. Pylori.
Препараты висмута в практике врача
Bисмута трикалия дицитрат может назначаться при лечении эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, вызванных приемом нестероидных противовоспалительных препаратов, а также в схеме эрадикации Helicobacter pylori. В статье описываются р
Bismuth subcitrate may be prescribed as a drug for treatment of erosive and ulcerative lesions of stomach and duodenum caused by non-steroid anti-inflammatory drugs, and also in the scheme of Helicobacter pylori eradication. This article describes the divergent effects of bismuth drugs, studies and metaanalyses in which these effects have been proven.
Висмут — химический элемент 15-й группы шестого периода периодической системы химических элементов Д. И. Менделеева; имеет атомный номер 83, представляет собой при нормальных условиях блестящий серебристый с розоватым оттенком металл. Собственно, как «висмут» элемент введен в химическую номенклатуру в 1819 г. шведским химиком Й. Берцелиусом. Не обладая ковкостью и тягучестью, висмут легко измельчается в порошок. Висмут был известен с давних времен (первые упоминания о нем в химической литературе относятся к XV веку), но долгое время его считали разновидностью олова, свинца или сурьмы. Представление о висмуте как о самостоятельном химическом элементе сложилось лишь в XVIII веке, после того как в 1739 г. немецким химиком И. Поттом была установлена его химическая индивидуальность [1, 2].
Биологическая роль висмута изучена слабо, ученые предполагают, что этот элемент индуцирует синтез низкомолекулярных белков, принимает участие в процессах оссификации, образует внутриклеточные включения в эпителии почечных канальцев. Современный уровень знаний не позволяет определенно говорить о какой-либо физиологической роли висмута в организме человека. Его поступление в организм с водой или пищей незначительно, т. к. всасывание висмута, поступившего в желудочно-кишечный тракт, крайне мало и составляет около 5%. Суточное поступление висмута в организм с продуктами питания составляет 0,02 мг, а с воздухом — 0,00001 мг.
Гораздо более вероятным представляется поступление висмута в организм с лекарственными препаратами при приеме их внутрь или через кожу (при наружном применении). Суммарно в организм человека с пищей, а также с воздухом и водой поступает висмута в количестве 5–20 мкг/сутки. После всасывания висмут обнаруживается в крови в виде соединений с белками, а также проникает в эритроциты. Между органами и тканями висмут распределяется относительно равномерно. Некоторое накопление висмута может наблюдаться в печени, почках (до 1 мкг/г), селезенке и костях. Обнаруживается висмут и в головном мозге. Висмут относится к категории тяжелых металлов, он является умеренно токсичным элементом. Ряд источников даже называет висмут «самым безобидным» из всех тяжелых металлов. Будучи очень близок по своим свойствам к свинцу, висмут значительно менее ядовит. В связи с этим экологи ратуют за постепенную замену свинца в промышленных и производственных процессах на висмут. Профессиональные отравления или кожные заболевания при работе с висмутом почти не отмечаются, канцерогенность этого металла также не установлена. Обычно даже громадные дозы висмута, принятые перорально, не вызывают отравления, что объясняется трудностью всасывания соединений висмута [2].
За транспортировку висмута к различным органам в организме ответственны лейкоциты. Захваченный лейкоцитами и разнесенный током крови и лимфы по всему организму висмут накапливается в селезенке, центральной нервной системе и органах выделения, к которым относятся почки, печень, кишечник, слюнные железы. Его биодоступность очень низка — 0,16–1,5% от принятой дозы. Средняя концентрация висмута в крови после курсового лечения не превышает 3–58 мкг/л. Следы этого элемента были обнаружены в поте, слезах и грудном молоке. Резорбированный висмут выделяется с мочой. Длительный прием препаратов висмута в больших дозах может вызвать симптомы «висмутовой» энцефалопатии (особенно у больных с нарушением функции почек). На основании анализа 945 клинических случаев было доказано, что побочные эффекты возникают лишь при применении очень высоких доз препаратов (до 20 г/сут) на протяжении длительного (2–20 лет и более) времени [3].
Висмут упоминается в трудах многих авторов книг XV–XVII веков, в частности, у Валентина и Парацельса. 150 лет назад некоторые соединения висмута применялись как обеззараживающее, подсушивающее, вяжущее и антисептическое средство. Висмут является элементом, который, подобно серебру, обладает антимикробными свойствами. Самостоятельное применение висмута для терапевтических целей по причине ряда нежелательных эффектов затруднительно, поэтому оптимизация применения висмута как антибактериального агента связана с разработкой соответствующих форм и комплексов (солей), позволяющих эффективно осуществлять транспорт данного иона к непосредственному месту действия. Терапевтическая активность соединений висмута известна достаточно давно и описана для различных солей висмута, а его пероральное и парентеральное введение предназначалось для лечения ряда заболеваний, таких как сифилис, стенокардия Винсента и амебиазная дизентерия [4]. Когда соли висмута стали широко востребованными, было налажено мелкосерийное производство их препаратов в виде микстур. Широкую известность в Великобритании первой половины XX века получил висмута аммония цитрат (ВАЦ), иногда висмута тартрат, известный как «висмут цитрат аммония с пепсином». Препараты висмута описаны в различных статьях британской фармакопеи (British Pharmaceutical Codex) начиная с издания 1929 г.
Примерно в это же время в Германии были разработаны препараты висмута, в качестве комплексообразователя в которых применялись белковые или пептидные гидролизаты и их фракции (German Pat. № 117 269, German Pat. № 101 683, German Pat. № 202 955). Но они обладали явными недостатками — это ненормируемое высвобождение ионов висмута, (обусловленное значениями рН желудка), адсорбировались в верхних отделах ЖКТ, образуя соединения, обусловливающие проникновение ионов висмута во внутренние среды организма. Эти недостатки способствовали поиску новых эффективных и безопасных производных висмута.
Соединения висмута обладают противоспирохетозным действием, и механизм их действия сводится к тому, что ионы висмута, проникая в спирохеты, связывают сульфгидрильные группы (SН) их ферментов, приводя к нарушению жизнедеятельности и гибели возбудителей сифилиса. Подобные препараты вводятся внутримышечно, так как при приеме внутрь висмутсодержащие соединения практически не всасываются из пищеварительного тракта. Однако при парентеральном поступлении висмута в организм существует опасность поражения тех органов, в которых накапливаются ионы висмута. Токсическая и летальная дозы восемьдесят третьего элемента для человека не определены. Опасным считается хроническое поступление висмута в количествах 1–1,5 грамма в день. Значение солей висмута в медицине с течением времени возрастает. На основе галлата, тартрата, карбоната, трибромфенолята, субцитрата и субсалицилата висмута разработано множество лекарств. В лечебной практике применяются такие препараты, как Викалин, Викаир, Викрам*, Нео-Анузол, Висмутовая мазь*, Дерматол, Ксероформ, Пентабисмол*, Бисмутогви*, Де-Нол, Новобисмол и другие.
Предыдущие исследования определили, что сочетание висмута с тиоловыми (-SH, сульфгидрильными) соединениями, такие как, например, этандитиол висмута, улучшают антимикробную активность висмута, по сравнению с другими его солями. Поиск новых оптимизированных трансмиттеров висмута продолжается, о чем свидетельствует недавний патент на изобретение [5], описывающий получение и применение висмут-тиоловой композиции в качестве эффективного антибактериального агента.
Сегодня в России гастроэнтерологи наиболее широко применяют коллоидный субцитрат висмута, или, как его еще называют, висмута трикалия дицитрат (ВТД). Открытие Helicobacter pylori (H. pylori) в 1983 г. австралийцами J. Warren и B. Marshall совершило революцию в лечении язвенной болезни [6], оно возобновило интерес к соединениям висмута, так как было установлено, что соли висмута эффективно подавляют рост H. pylori в сочетании с антибиотиками или в комбинации с антибиотиками и кислотосупрессивными препаратами [7, 8]. Первое рандомизированное контролируемое исследование (РКИ) с применением висмута в антихеликобактерной терапии выявило, что висмут был эффективнее монотерапии эритромицином [9]. Другое РКИ в течение 6 недель сравнивало эффективность коллоидного субцитрата висмута против циметидина при H. pylori-положительной язвенной болезни двенадцатиперстной кишки, в результате висмут успешно эрадицировал H. pylori у 50% больных [10]. Следующее РКИ оценивало совместное применение коллоидного субцитрата висмута и циметидина, отдельно или в сочетании с тинидазолом, в результате было выявлено, что коллоидный субцитрат висмута и тинидазол достигли эрадикации H. pylori почти у 75% пациентов [11]. С добавлением второго антибиотика тетрациклина или амоксициллина частота эрадикации в более поздних РКИ превысила уже 80% [12–14]. Тем не менее, были выявлены некоторые проблемы, связанные с тройной терапией на основе висмута, — это большое количество таблеток, которые пациенты были обязаны принять, продолжительность терапии и побочные эффекты, например, изменение вкуса, тошнота и диарея. Систематический обзор и метаанализ A. Ford и соавт. убедительно свидетельствуют о том, что соединения висмута, используемые либо отдельно, либо в сочетании с антибиотиками и ингибиторами протонной помпы (ИПП) для эрадикации H. pylori, являются безопасными и хорошо переносятся [15].
ВТД замедляет процессы всасывания некоторых антибиотиков (тетрациклин, амоксициллин), способствуя тем самым повышению их концентрации в желудочном содержимом — месте приложения при лечении хеликобактериоза. В исследованиях in vitro и in vivo было показано, что ВТД обладает синергизмом с другими антибиотиками в отношении H. pylori. Благодаря этому свойству он стал непременным компонентом антихеликобактерной терапии, а его сочетание с двумя антибиотиками и поныне называют «классической тройной терапией». Кроме того, одним из способов преодоления резистентности H. pylori является применение в качестве базисного препарата коллоидного трикалия дицитрата висмута. Это положение подтверждается изучением антибактериальной активности in vitro комбинаций различных препаратов с кларитромицином и амоксициллином в отношении штаммов H. pylori, чувствительных или резистентных к макролидам. Было показано, что свойства ВТД играли решающую роль в преодолении резистентности штаммов и получении стойкого бактерицидного эффекта указанных комбинаций препаратов [16].
Механизм антибактериального действия висмута трикалия дицитрата связан не только с нарушением адгезии микроорганизмов к эпителию слизистой оболочки, но и с нарушением синтеза АТФ в бактериальной клетке. Так, в исследовании in vitro инкубация H. pylori с висмута трикалия дицитратом приводила к выраженному угнетению роста микроорганизма и его последующей гибели [18]. Благодаря антихеликобактерной активности препараты коллоидного висмута позволяют повысить или сохранить эффективность эрадикационной терапии, особенно в условиях растущей антибиотикорезистентности H. pylori. Антихеликобактерный моноэффект ВТД составляет в среднем 14–40%. Преимущество препарата состоит в том, что не существует естественной или приобретенной резистентности H. pylori к ионам висмута. Сочетание с антибиотиками увеличивает степень эрадикации до 50%, а сочетание двух базисных препаратов — ингибитора протонной помпы и висмута трикалия дицитрата — с двумя антибиотиками позволяет преодолеть резистентность штаммов H. pylori к производным нитримидазолов либо кларитромицину.
Интересные результаты представили C. Srinarong и соавт. — 7-дневная стандартная тройная терапия плюс ВТД и пробиотик обеспечили отличную эрадикацию H. pylori (100%) в районах с низкой его резистентностью к кларитромицину, таких как Таиланд, независимо от CYP2C19 генотипа возбудителя [19].
В последние годы показано значение окислительного стресса, потенцируемого бактериями H. pylori (особенно имеющими генотип CagA+/vacAs1), в развитии хронического гастрита [20]. Препараты висмута оказались способными улавливать свободные кислородные радикалы, образующиеся при окислительном стрессе и повреждающие СО желудка, что служит одной из составляющих их цитопротективного действия [21].
BTД хорошо зарекомендовал себя и как препарат, который с успехом может назначаться при лечении эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, вызванных приемом нестероидных противовоспалительных препаратов (НПВП-ассоциированной гастропатии). Так, при сравнительном изучении эффективности применения ВТД и ранитидина заживление язв и множественных эрозий желудка и двенадцатиперстной кишки через 4 нед лечения было достигнуто у 84,6% больных, получавших ВТД, и лишь у 50% пациентов, получавших ранитидин [22]. В сравнительном исследовании по эффективности применения ВТД (в дозе 240 мг 2 раза в сутки) в комбинации со стандартной дозой омепразола (20 мг в сутки) и монотерапии омепразолом у больных с НПВП-ассоциированной гастропатией заживление эрозивно-язвенных поражений желудка и двенадцатиперстной кишки через 2 нед лечения было достигнуто соответственно у 56,7% и 30,3% больных, а через 4 нед — у 100% и 93,9% пациентов. Повышение уровня простагландинов в СО желудка, отмечавшееся на фоне приема ВТД, свидетельствовало о цитопротективном действии препарата [23, 24].
Благодаря известным антидиарейным свойствам, соединения висмута широко используются для лечения эпизодических поносов у детей и взрослых на протяжении целого столетия [25–28]. Ряд исследований подтвердили эффективность висмута субсалицилата в профилактике и лечении диареи (E. coli энтеротоксигенной) путешественника. Энтеротоксигенная E. coli обнаруживалась реже у тех путешественников, которые получали висмута субсалицилат, чем у тех, кто получали плацебо, доказывая, что висмута субсалицилат предотвращает диарею, уменьшая количество и подавляя размножение энтеротоксигенной E. coli [29].
Два исследования сообщили об эффективности лечения висмутом в клизмах при язвенном колите с поражением дистальных отделов. Клинико-лабораторное улучшение наблюдалось у 60% пациентов, резистентных к обычной терапии, а у 40% пациентов была достигнута полная ремиссия после 8 недель терапии [30]. Многоцентровое, двойное слепое, рандомизированное, сравнительное исследование показало, что при сравнении эффективности лечения висмутом в клизмах с клизмами 5-аминосалициловой кислоты был установлен эквивалентный терапевтический эффект при лечении левостороннего язвенного колита [31]. Пероральный висмут также эффективен при микроскопическом колите [32] и в качестве колостомического дезодоранта [33].
В дополнение к своим антибактериальным свойствам [34, 25], висмут также обладает противовоспалительными эффектами [36] при прохождении по кишечнику. Существуют экспериментальные данные, подтверждающие роль висмута в ингибировании активности индуцируемой синтазы оксида азота в эпителиальных клетках кишечника, а также в индукции гемоксигеназы-1, тем самым обуславливая терапевтический эффект при воспалительных и окислительных реакциях, связанных с воспалительными заболеваниями кишечника [37]. Еще одно экспериментальное исследование показало способность висмута поглощать кислород свободных радикалов в контексте химических повреждений слизистой желудка [38]. Учитывая эти антибактериальные и противовоспалительные механизмы, можно теоретически предположить, что висмут должен играть определенную роль в патогенетическом лечении острой и хронической диареи, как антибактериальный и антитоксический агент [39].
Сероводород, другие зловонные и токсичные соединения продуцируются бактериями толстой кишки при гниении белка. При умеренно тяжелой форме язвенного колита [40] сероводород участвует в ингибировании окисления бутирата слизистой толстой кишки, что делает слизистую оболочку более уязвимой к воспалительным агентам [41, 42]. Висмут, соединяясь с сероводородом, образует нерастворимый безвредный сульфид висмута и окрашивает кал в черный цвет [43].
Целью нашего оригинального исследования стала оценка сравнительных характеристик инфракрасных спектров (ИК-спектров) двух готовых лекарственных форм висмута. В исследовании проанализированы спектральные характеристики наиболее востребованных висмут-содержащих препаратов, а именно препаратов Де-Нол® (Нидерланды) и Новобисмол® (Россия). Активным действующим веществом этих препаратов является висмута трикалия дицитрат.
Таким образом, данное исследование указывает на практически полную фармацевтическую эквивалентность исследованных нами препаратов Де-Нол® и Новобисмол®.
Литература
ГБОУ ВПО КемГМА МЗ РФ, Кемерово
Ответы на вопросы
Юлия Олеговна Шульпекова, доцент, кандидат медицинских наук:
– Вопрос 1. Что можно рекомендовать пациентам с запором при основном диагнозе «рак поджелудочной железы»? Я думаю, здесь следует избегать стимулирующих слабительных, а вполне как раз безопасны осмотические слабительные: «Форлакс», например, и «Лактулоза», а кроме того, пищевые волокна.
Вопрос 2. Отношение к препарату «Прукалоприд» в лечении синдрома раздраженного кишечника. Наше отношение, вот мое лично – очень хорошее. Его эффективность доказана при гипотоническом запоре, то есть когда стул редкий и не выглядит, как овечий кал, когда он достаточно мягкой консистенции – это наиболее подходящая ниша, вялая перистальтика, для назначения «Прукалоприда». В настоящее время по инструкции «Прукалоприд» должен назначаться женщинам, но с определенными оговорками можно обосновать его назначение и мужчинам при неэффективности других средств.
Вопрос 3. Можно ли назначать «Форлакс» пациентам старше 80 лет на фоне артериальной гипертонии? Да, препарат «Форлакс» как раз хорошо подходит для лечения пожилых людей, для избежания заворотов кишечника в результате запора, и при артериальной гипертонии он безопасен при соблюдении лечебных доз.
Вопрос 4. Что лучше при синдроме раздраженного кишечника: «Афобазол» или «Эглонил»? В данном случае лучше, конечно, посоветоваться с психиатром, поскольку эти препараты однотипные, противотревожные средства. Единственное, «Эглонил» – это все-таки нейролептик, он может повлиять на время реакции, на вождение автомобиля. А в принципе, препараты могут оказаться оба равноценно эффективными при тревожных расстройствах.
Шептулин Аркадий Александрович, профессор, доктор медицинских наук:
– У меня тоже несколько вопросов.
Алексей Владимирович Кононов, профессор, доктор медицинских наук:
Шептулин А.А.:
– Да, я могу добавить. Естественно, этот вопрос очень хорошо изучен. Вот сравнили разные способы, и, кстати говоря, некоторые препараты, синтетические аналоги простагландинов, называл и о них говорил (о «Мизопростоле») Алексей Владимирович. H2-блокаторы и ингибиторы протонной помпы. Все-таки наибольшей эффективностью в отношении профилактики поражения слизистой оболочки, связанной с приемом ацетилсалициловой кислоты и нестероидных противовоспалительных препаратов, облают ингибиторы протонной помпы. Я не буду на этом заострять внимание, но существуют рекомендации: как, каким больным назначать – это все имеется в литературе.
Я позволю себе ответить о препаратах висмута. Следует ли применять препараты висмута уже на начальной стадии лечения хеликобактера. Существуют препараты, схемы первой линии и второй линии. Традиционно мы всегда рассматривали квадротерапию с препаратами висмута как препараты второй линии. В настоящее время эта схема квадротерапии наряду со схемой классической тройной терапии может использоваться и как терапия первой линии.
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Спасибо большое, уважаемые эксперты. Спасибо большое, уважаемые коллеги, за интересный симпозиум.
Современные подходы к лечению язвенной болезни желудка и двенадцатиперстной кишки
В конце ХХ в. был сделан значительный шаг к изменениям принципов лечения язвенной болезни (ЯБ). Успех современных подходов к терапии связан, прежде всего, с применением новых антисекреторных препаратов и схем эрадикации Helicobacter pylori (НР).
В конце ХХ в. был сделан значительный шаг к изменениям принципов лечения язвенной болезни (ЯБ). Успех современных подходов к терапии связан, прежде всего, с применением новых антисекреторных препаратов и схем эрадикации Helicobacter pylori (НР). В настоящее время фармакотерапия ЯБ включает более 500 различных препаратов и около 1000 их сочетаний. Современная концепция лечения ЯБ предусматривает активную терапевтическую тактику, включающую многокомпонентные лекарственные схемы и длительный прием медикаментов по показаниям.
Важный компонент современной фармакотерапии язвенной болезни — это отсутствие принципиальных различий в подходах к лечению язв желудка и двенадцатиперстной кишки. Основными принципами терапии язвенной болезни являются:
В настоящее время в патогенезе ЯБ, особенно дуоденальной язвы, большое значение придают инфекционному агенту — H. pylori. Эпидемиологические данные, полученные в различных странах, свидетельствуют о том, что 100% язв двенадцатиперстной кишки и более 80% язв с локализацией в желудке связаны с персистированием НР.
Множество исследований подтверждает, что антихеликобактерная терапия приводит к снижению частоты рецидивов язвенной болезни желудка (ЯБЖ) и двенадцатиперстной кишки (ДПК). Стратегия лечения ЯБ с помощью эрадикации инфекции НР обладает неоспоримыми преимуществами перед терапией всеми группами противоязвенных препаратов, так как обеспечивает длительную ремиссию заболевания и, возможно, полное излечение. Антихеликобактерная терапия хорошо изучена в соответствии со стандартами доказательной медицины [8]. Современные подходы к диагностике и лечению инфекции H. pylori, отвечающие требованиям доказательной медицины, отражены в итоговом документе второго Маастрихтского консенсуса, принятом в сентябре 2000 г. Главными отличиями нынешнего документа от соглашения пятилетней давности являются несколько важных пунктов [5].
Основным критерием для выбора антихеликобактерной терапии служит ее предполагаемая эффективность, обеспечивающая высокий процент эрадикации (более 80%).
Правила и рекомендации Российской гастроэнтерологической ассоциации по лечению инфекции НР к применению антихеликобактерной терапии.
Принятие Российской гастроэнтерологической ассоциацией в 1998 г. национальных рекомендаций по диагностике и лечению хеликобактерной инфекции и массовое ознакомление с ними врачей не привели пока к снижению числа стратегических и тактических ошибок в определении показаний к эрадикации и выборе адекватных антихеликобактерных схем (см. таблицу 1) [4].
Таблица 1. Ошибки в лечении НР-инфекции.
Что необходимо знать врачу, начинающему проведение антихеликобактерной терапии? Каждому врачу общей практики, особенно со стажем работы более пяти лет, скорее всего, придется преодолеть некий психологический барьер, перед тем как назначить пациенту с язвенной болезнью антибиотики. На сегодняшний день врачи-гастроэнтерологи и терапевты пока по-разному относятся к антихеликобактерной терапии при ЯБ. Необходимо строгое, неукоснительное соблюдение схемы антихеликобактерного лечения [10]. Эффективность их доказана, они соответствуют особенностям НР и фармакокинетике препаратов, известны также побочные эффекты такой терапии.
Лучше не проводить антихеликобактерную терапию вообще, нежели проводить ее неправильно — так как в этом случае быстро развивается устойчивость НР к целому ряду компонентов. В связи с этим пациенту необходимо подробно рассказать о предстоящем лечении и заручиться его согласием на сотрудничество с врачом. Важно также оценить материальные возможности больного. Он должен знать, что благодаря дорогостоящему, однократному лечению удастся добиться стойкой ремиссии у больных ЯБ ДПК в 70–80% случаев, а при ЯБЖ — в 50–60%, что в конечном счете экономически выгодно.
Какую схему эрадикации выбрать? Если имеется язва желудка или ДПК на фоне повышенной кислотопродукции, то предпочтение следует отдать классическим трехкомпонентным схемам на основе блокатора протонного насоса (ИПП) (омепразол и т. д.). Затем возможен переход на разовый прием ИПП без антибактериальных препаратов. Не следует использовать схемы, содержащие нитроимидазолы (метронидазол, тинидазол), если в анамнезе препараты данной группы назначались по другим показаниям.
В настоящее время в России наблюдается резкое увеличение числа штаммов НР, устойчивых к нитроимидазолам [2, 9]. С учетом этого актуальной задачей на сегодняшний день представляется поиск более действенных режимов эрадикации НР. Поэтому в последние годы растет интерес к применению макролидов при лечении НР-ассоциированных заболеваний. Многочисленными работами показана эффективность применения макролидных антибиотиков для лечения НР. Эти препараты обладают высокой способностью проникать в клетки, интенсивно выделяются на слизистые оболочки (СО), что увеличивает их эффективность против НР. Кроме того, у макролидных антибиотиков меньшее число противопоказаний, а также побочных эффектов, у них более высокий процент эрадикации, чем у тетрациклинов, которые также могут накапливаться в клетках [11]. Особенность НР-инфекции заключается в том, что она сопровождается гиперацидностью.
В связи с этим большинство антибиотиков-макролидов подвергается усиленному гидролизу и не может использоваться. Исключение составляет кларитромицин, устойчивый к действию соляной кислоты [11].
Поэтому целью нашего исследования явилась разработка новых схем эрадикационной терапии ЯБ ДПК, ассоциированной с H. pylori, с использованием омепразола (О), а также комбинации амоксициллина (А) и кларитромицина (К). Мы использовали следующую схему эрадикации — ультоп (омепразол) 20 мг два раза в день + фромилид (кларитромицин) 500 мг два раза в день + хиконцил (амоксициллин) 1000 мг два раза в день — курс семь дней. Эрадикация составила 90%. Проведенное исследование показало, что использование фромилида (кларитромицина) эффективно и целесообразно в схемах антихеликобактерной терапиии с применением ИПП.
Данные многочисленных исследований и результаты их метаанализа позволили сделать заключение, что включение антисекреторных препаратов в схемы эрадикации НР-инфекции не только улучшает эрадикацию HP при сочетании с антибиотиками, но и способствует ускорению рубцевания язвы, позволяет быстрее устранить симптомы язвенной диспепсии. Что касается конкретных механизмов повышения эффективности эрадикации вследствие приема антисекреторных препаратов, то, прежде всего, при повышении рН желудочного содержимого снижается показатель минимальной подавляющей концентрации антибиотиков (МПК) и соответственно растет их эффективность. Также повышаются вязкость желудочного сока и концентрация антибиотика в желудочном содержимом, что увеличивает время экспозиции антибактериальных препаратов с бактерией H. pylori [11]. Нами была исследована эффективность ультопа (омепразола) — рН > 4 желудочного содержимого при однократном приеме 20 мг была на протяжении 12–14 ч (см. рисунок 1).
С помощью рН-метрии у НР-негативных добровольцев изучено действие новой лекарственной формы лосек МАПС. После курса лечения этим препаратом антисекреторный эффект
в дневное время оказался даже более выражен, чем при применении пантопразола [9]. Однако фармацевтические компании, продолжавшие поиск новых, более эффективных антисекреторных средств, создали новый препарат — нексиум. Антисекреторный эффект нексиума превосходит по выраженности, быстроте наступления и продолжительности воздействия подобный же эффект омепразола в стандартных дозах 20 и 40 мг, пантопразола 40 мг и лансопразола 30 мг [8].
В связи с вышеизложенным большой интерес представляет новый ИПП — париет (рабепразол) [3]. При лечении ЯБЖ И ДПК рекомендован прием париета в дозе 40 мг один раз в сутки или 20 мг через 12 ч. Наиболее эффективным, быстродействующим антисекреторным и антибактериальным препаратом в схемах эрадикации является париет в дозе 20 мг два раза в день. Его не надо назначать за семь дней до начала лечения антибиотиками, как в случае применения других ИПП, так как надежный антисекреторный эффект достигается уже в первый день лечения (из рекомендаций Российской гастроэнтерологической ассоциации).
К сожалению, наличие у некоторых больных резистентности НР к антибиотикам вынуждает исследователей разрабатывать альтернативные варианты лечения пациентов, страдающих язвенной болезнью, ассоциированной с H. pylori.
Так, нами изучена эффективность эрадикационных схем с применением резервных антибактериальных препаратов. Наилучший результат эрадикации (90%) был достигнут при использовании схемы: де-нол 240 мг два раза в день, 14 дней + тетрациклин 1 г/сут и фуразолидон 200 мг два раза в день, семь дней.
Достаточно часто встает вопрос о необходимости проведения эрадикационной терапии у лиц пожилого и старческого возраста. На сегодняшний день это можно связать с тем, что при длительной персистенции НР развиваются кишечная метаплазия и атрофия слизистой желудка, увеличивается риск развития карциномы желудка. Возрастные особенности ферментативной активности и атрофические процессы в СО желудочно-кишечного тракта также изменяют скорость биотрансформации лекарственных средств, нарушают их всасывание. Отмечено, что концентрация ранитидина повышается у пациентов старше 60 лет с сопутствующей патологией гепатопанкреатобилиарной области [1].
«Ахилесовой пятой» консервативного лечения язвенной болезни является, как известно, высокая частота осложнений. Доказано, что эрадикация НР полностью предотвращает осложнения язвенной болезни. Так, в ходе четырех крупных исследований изучалось течение язвенной болезни у пациентов, у которых она манифестировала кровотечением (см. рисунок 2). Как видно, из представленных данных, любой другой вид лечения не исключает опасности повторного кровотечения, — в течение года после предыдущего кровотечения оно рецидивирует примерно у каждого третьего больного. В случае же эрадикации НP кровотечения не повторяются вовсе (см. рисунок 2).
| Рисунок 2. Частота рецидивов кровотечений после курса эрадикационной терапии. |
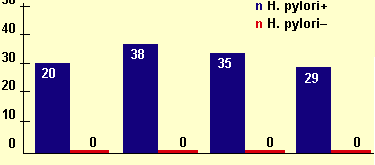 |
Оценка эффективности эрадикации проводится после завершения лечения и направлена на выявление вегетативных и кокковых форм Н.pylori. В «Рекомендациях» четко определяется схема проведения этого этапа диагностики:
Нельзя недооценивать роль антацидных препаратов в лечении ЯБЖ и ДПК. Данные препараты, известные еще с глубокой древности, понижают кислотность желудочного сока за счет химического взаимодействия с кислотой в полости желудка. Предпочтение отдается не всасывающимся антацидам — альмагель, маалокс, фосфалюгель, тальцид, рутацид. При обострении ЯБЖ и ДПК в комплексном лечении мы использовали рутацид в дозе 500 мг три раза в день + одна таблетка перед сном. На фоне приема этого средства симптомы желудочной диспепсии исчезали
к концу первого-второго дня лечения. Несмотря на введение в медицинскую практику современных ингибиторов желудочной секреции антациды сохраняют значение как эффективное средство лечения больных с ЯБЖ и ДПК.
В результате лечения должна быть достигнута полная клинико-эндоскопическая ремиссия, при отрицательных результатах НР-тестирования.
Следует отметить, что мы очень редко сталкиваемся со случаями, когда у больного имеется изолированная язва. Лечение сочетанной патологии сопряжено с рядом проблем.
Иногда консервативная терапия оказывается неэффективной. Это может быть обусловлено двумя факторами: часто рецидивирующим течением язвенной болезни и формированием рефрактерных гастродуоденальных язв. Проведенный анализ выявил причины частых рецидивов в течении ЯБ, это — НР-инфекция, прием нестероидных противовоспалительных препаратов, наличие осложнений ЯБ в анамнезе, а также низкая комплаентность. В качестве факторов, способствующих формированию рефрактерных гастродуоденальных язв, могут выступать вышеперечисленные причины, а также скрыто протекающий синдром Золлингера-Эллисона.
В заключение следует еще раз подчеркнуть крайнюю важность разработки отечественных стандартов лечения ЯБЖ И ДПК и скорейшего их внедрения в практику врача — терапевта и гастроэнтеролога. Важные аргументы в пользу проведения антихеликобактерного лечения получены при оценке соотношения стоимость/эффективность. ЯБ широко распространена и характеризуется хроническим рецидивирующим течением. Эрадикация H. pylori снижает как прямые, так и косвенные затраты при ЯБ, при этом исключается необходимость дорогостоящего поддерживающего лечения антисекреторными препаратами, снижается риск повторных обострений, возникновения осложнений и, в ряде случаев, хирургическое лечение.
Таким образом, современная медикаментозная терапия ЯБ ДПК и ЯБЖ может обеспечить безрецидивное течение этих заболеваний и избавить больных от осложнений. При этом в большинстве случаев амбулаторного лечения оказывается достаточно. Успех терапии зависит не только от назначения оптимальной лекарственной комбинации, но и, в значительной степени, от ее реализации с участием больного.
Литература.
И. В. Маев, доктор медицинских наук, профессор МГМСУ, Москва
_575.gif)