что лучше применять в качестве реактора тигли
«Лабораторный практикум по неорганическому синтезу» (стр. 7 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 |
При проведении реакции следует брать не менее 25 − 30 г исходных веществ (суммарно). С большим количеством веществ реакции идут лучше, и выход металлов увеличивается. Масса восстановителя (алюминия) должна быть равна теоретически рассчитанной массе.
Чтобы получить металл или сплав без алюминия, следует брать его несколько меньше теоретически рассчитанного на 1 – 2 %.
В качестве восстановителя можно использовать смеси порошкообразных металлов или смеси металлов с кремнием, например:
4Cr2O3 + 3Mg + 6Al = 8Cr + 3Mg(AlO2) 2
Несмотря на то, что алюминат магния плавится при 2135оC, т. е. выше, чем оксид алюминия, реакции со смесью восстановителей идут лучше. Это объясняется тем, что при использовании данной смеси металлов теплоты выделяется больше, чем при использовании в качестве восстановителя алюминия. Например, алюминий оксид хрома (III) непосредственно не восстанавливает ввиду недостаточного количества выделяющейся теплоты. А смесь алюминия с магнием или кальцием этот оксид восстанавливает.
Приготовление зажигательной смеси и заполнение реактора. Зажигательную смесь готовят смешиванием 9 масс. ч. растертого пероксида бария с 1 масс. ч. порошкообразного алюминия. Можно использовать смесь, приготовленную из 4 масс. ч. растертого пероксида бария и 1 масс. ч. порошкообразного алюминия с добавлением 0,7 масс. ч. отдельно растертого хлората калия. Иногда берут 3 масс. ч. растертого нитрата калия и 1,3 масс. ч. алюминиевой пудры. Смешивать эти вещества нужно очень осторожно! Зажигательную смесь хранят в сухой, хорошо закупоренной стеклянной банке; приготовлять ее в больших количествах не рекомендуется.
Заполнение реактора шихтой. В качестве реактора используют магнезиальные или корундовые тигли, так как они термически стойки и вещества при работе с ними меньше загрязняются. Фарфоровые тигли, как правило, разрушаются. Поэтому их нужно помещать в песок, чтобы расплавленная масса не выливалась. Более удобны шамотовые или глиняные тигли, но в этом случае продукт несколько загрязняется кремнием и другими веществами.
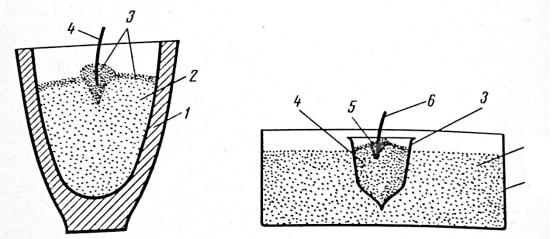
Тигель 1 (рис.13) заполняют на ¾ его высоты смесью из оксида и восстановителя. Утрамбовывают массу, делают небольшое углубление и засыпают сверху тонким слоем (1 – 1,5мм) зажигательной смеси. Ленту магния вставляют в углубление, которое, которое затем заполняют зажигательной смесью в форме горки. Если лента магния покрыта слоем оксида, ее следует очистить ножом.
Меры предосторожности. Реакцию проводят в вытяжном шкафу, откуда убирают все легковоспламеняющиеся материалы. Тигель помещают в песок. Работают в защитных очках!
Проведение опыта. Зажигательную смесь поджигают при помощи магниевой ленты, которую можно поджечь длинной лучиной. Если имеются магниевые стружки, то можно поджечь магний, зажав стружки длинными тигельными щипцами, и бросить их на зажигательную смесь.
Разделение продуктов реакции. После окончания реакции тигель охлаждают, разбивают и «королек» металла отделяют от шлака. Иногда кусочки металла остаются в шлаке в виде включений. В этом случае шлак нужно разбить и отделить от него металл; кусочки шлака, приставшие к металлу, удаляют с помощью молотка на стальной плите.
Методики синтеза некоторых металлов.
Зажигательную смесь готовят встряхиванием в банке 6,75г BaO2 c 0,75г Mg порошка. Тигель поставить в баню с песком. Опыт проводить в вытяжном шкафу (надеть очки, перчатки). Осторожно поджечь ленту магния длинной горящей лучиной. После вспышки дать остыть расплавленной массе, разбить тигель и вынуть королек металла.
Реакционная смесь из 8г покаленного Cr2O3, 8г сплавленного K2Cr2O7 и 8г Al порошка. Все вещества тщательно перемешать в ступке. На дно шамотового тигля насыпать 5г CaF2, а затем реакционную смесь.
Зажигательная смесь: 1вес. ч. (4г) порошка Al и 3 вес. ч. (12г) перекиси бария.
3. Получение марганца.
Приготовить смесь из порошкообразного Mn2O3/Mn3O4 (готовится прокаливанием порошка MnO2 в муфельной печи при 900оС), порошка Al и свежепрокаленной окиси кальция, который добавляют для уменьшения вязкости шлака и облегчения расслаивания реакционной массы, превращая Al2O3 в алюминат кальция, а не в алюминат марганца.
Mn3O4 : Al : CaO = 15 : 10 : 2,5 (Mn3O4 : Al : CaO = 7,5г : 5г : 1,25г)
Зажигательная смесь: 1 вес. ч.(2г) Al порошка и 3 вес. ч.(6г) перекиси бария.
4. Получение железа.
6.3 Вопросы и задания для самостоятельной работы к Модулю 6
1. Какое положение занимает алюминий в Периодической Системе? Написать электронную конфигурацию атома алюминия; какие степени окисления он может проявлять; каковы его валентные возможности?
2. В виде каких соединений алюминий встречается в природе; как его получают в промышленности?
3. Какое положение занимает алюминий в ряду напряжений металлов?
4. Как относится алюминий к кислороду воздуха, воде, кислотам, растворам щелочей? ем объяснить устойчивость алюминия к концентрированным растворам серной и азотной кислот?
5. Как получить из оксида алюминия: алюминат натрия, трихлорид алюминия?
6. Привести примеры комплексных соединений алюминия.
7. В каких условиях можно получить гидрид алюминия; какими свойствами он обладает?
8. В чем состоит сущность процесса алюмотермии?
6.4 Вопросы для самоконтроля к модулю 6
1. Как взаимодействует алюминий с: серой, углеродом, азотом, галогенами, фосфором?
2. Будет ли взаимодействовать металлический алюминий с растворами: поваренной соли, соды, соляной кислоты, сулемы, хлорной меди?
3. Как практически можно убедиться в том, что гидроксид алюминия обладает амфотерными свойствами?
4. Написать уравнение реакции гидролиза гидроксоалюмината калия.
5. Написать уравнения реакций получения: оксида алюминия из нитрата алюминия; сульфата алюминия из оксида алюминия.
6. Что обычно используют в качестве восстановителя при проведении алюмотермического восстановления оксидов?
7. Почему некоторые оксиды не восстанавливают алюмотермически, хотя термодинамически эти процессы возможны?
8. Какие меры предосторожности необходимо соблюдать в процессе алюмотермического восстановления оксидов?
9. Чем чаще всего может быть загрязнен металл, полученный алюмотермическим путем?
Проектное задание к модулю 6.
Провести синтез металла из его оксида алюмотермическим способом. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества.
Тест рубежного контроля к модулю 6.
1. Какие из перечисленных оксидов можно восстанавливать алюмотермически?
г) V2O5, Fe2O3, Cr2O3
2. Почему не восстанавливают алюмотермически MnO2, CrO3?
а) слишком большая скорость, разбрасывание реакционной смеси
б) слишком маленькая скорость реакции
в) частичное разложение или испарение оксидов
г) при реакции выделяется очень мало теплоты
3. Наиболее части в качестве восстановителя при металлотермии используют
г) кальций или магний
4. Чем может быть загрязнен основной продукт?
5. Какой состав зажигательной смеси используют при алюмотермии
6. Что лучше применять в качестве реактора?
а) корундовые тигли
б) стеклянные пробирки
г) фарфоровые тигли
Перечень рекомендованной литературы
3 Г. Брауэр. Руководство по препаративной неорганической химии. М.: «Мир», Т.1-6. 1985
8 Ахметов и неорганическая химия. М.: Высш. шк., 1988.
10 Некрасов общей химии. М.: Химия, 1972, 1973. Т.1,2.
11 Уилкинсон Дж. Современная неорганическая химия. М.: Мир, 1969. Ч. 1-3.
12 А. Уэллс. Структурная неорганическая химия, М.: Мир, 1987. Т.1-3.
14 Химическая энциклопедия: в 5-ти т. – М.: Советская энциклопедия, 1988-1998
Сушка и спекание кислой футеровки индукционных печей для плавки чёрных металлов
Сушка и спекание кислой футеровки индукционных печей для плавки чёрных металлов
Температура спекания чистых кварцитов около 1700 °C, т.е. значительно выше рабочей температуры, путем добавления борного ангидрида или борной кислоты температура спекания снижается. Процесс спекания начинается после плавления борного ангидрида (450 °C) и завершается при 1500 °C. Вследствие процесса спекания сухой кварцитной массы в стенке тигля печи образуются 3 зоны футеровки (см. рис.2): I зона — полного спекания, прилегающая к расплавленному металлу, II зона — малоспеченная, III зона — неспекшейся массы или буферная зона.
С целью экономии металла, расходуемого на изготовление выплавляемого шаблона, спекание кварцитовой футеровки можно производить быстрым разогревом выемного шаблона.
После того как шаблон имеет хорошую посадку, производят набивку стен тигля кварцитовой массой, уплотняя ее вибратором. В шаблон вновь изготовленного тигля загружают стартовые блоки, включают печь и разогревают до 800-900 °C не допуская признаков расплавления металла, затем выключают печь, закрывают ее крышкой и через 3 ч прекращают подачу воды в индуктор. Во время быстрого разогрева шаблона происходит спекание поверхности сухой набивочной массы без оплавления шаблона. При этом толщина спеченного слоя через три часа составляет 2-3 мм. Частицы молотого кварцита, применяемого для этой цели, должны иметь угловатое строение. Песок для этой цели непригоден. Весьма важным является использование сухой набивной массы с добавкой борного ангидрида. Борная кислота для этой цели непригодна. Следует обратить внимание на то, чтобы влажность кварцита не превышала 0,2 %.
При использовании для спекания тигля выемного шаблона желательно любой кварцит подвергать прокаливанию до 300-400 °C. После спекания и охлаждения футеровки вынимают стартовые блоки. Существует 2 способа применения выемных шаблонов. Первый способ заключается в применении основного разборного шаблона из стали и вспомогательного шаблона из миканита, которым основной шаблон оборачивается и крепится на основном шаблоне изоляционной лентой. Для спекания тигля при этом используется стартовый блок (болванка толщиной 80-100 мм), укладываемый на подину печи, или укладываются пакеты жести, мелкий скрап,затем в тигель заливают чугун с температурой 1300-1350 °C. Заливка тигля чугуном должна быть осуществлена непрерывно за 30-40 мин до уровня воротника печи. Второй способ заключается в применении для формовки тигля конического хорошо обработанного выемного шаблона, покрытого спиртовой графитовой краской. В стенке шаблона сверлят отверстия, обеспечивающие проход воздуха при извлечении шаблона из отформованного тигля. Шаблон нагревают до 400 °C газовой горелкой, охлаждают и извлекают. Для вытягивания конического шаблона над печью устанавливают металлический крест (опору), шаблон перед вытягиванием слегка расшатывают, при этом не требуется кран большой грузоподъемности.
Во всех случаях авторы указывают на необходимость применения в качестве спекающей добавки борного ангидрида, так как борная кислота содержит в себе 44 % воды, которая при разогреве тигля разрыхляет структуру футеровки и ухудшает состояние изоляции индуктора.
Для 25-т печей шаблон изготавливают из 3-х частей с различной конусностью. При хорошем уходе выемной шаблон 5-т печи вынимался 1060 раз. Выемные шаблоны могут быть использованы всеми предприятиями, эксплуатирующими в настоящее время печи серии ИЧТ и ИСТ емкостью до 10 т.
Использованная литература:
1. Сасса В.С. Футеровка индукционных печей. М.: «Металлургия», 1989, 232 с.
2. Получение простых веществ
2.1. Восстановление водородом
Реакции восстановления оксидов водородом наиболее часто используют для получения металлов и некоторых неметаллов в чистом состоянии. Особенность этих реакций состоит в том, что они являются обратимыми и гетерогенными. Равновесие может быть смещено как в сторону получения металла и паров воды, так и в сторону исходных продуктов, что определяется прочностью восстанавливаемого оксида.
Водород относится к сравнительно слабым восстановителям, но равновесие смещается в сторону образования металла, так как один из продуктов – пары воды – легко удаляется из зоны реакции током водорода.
С понижением степени окисления прочность оксидов увеличивается, и константа равновесия подобных реакций сильно уменьшается. Таким образом, возможность получения металлов и неметаллов восстановлением оксидов определяется прочностью низших оксидов.
SiO 2 (т) + 2H 2 (г) = Si (т) + 2H 2 O (г)
Реакции восстановления водородом начинаются при температуре около 200-400 о С и в большинстве случаев идут с небольшими скоростями. Металлы, получаемые при умеренных температурах, часто обладают пирофорностью, т.е. самовоспламеняются на воздухе. Металлы, полученные при высоких
температурах, пирофорностью не обладают. Объясняется это тем, что при высоких температурах увеличивается подвижность атомов, поэтому образуются более крупные кристаллы металла.
Если температура восстановления близка к температуре плавления, металлы получаются в виде плотной губки. При температурах восстановления выше температуры плавления металлы получаются в сплавленном виде. Выбор метода восстановления определяется свойствами исходного оксида, а также требуемой формой получения металла.
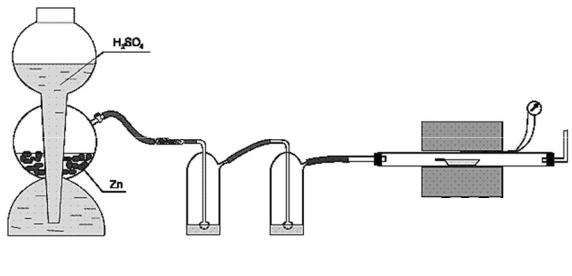
Если температура восстановления выше 600-650 о С, реакцию проводят в трубчатых электропечах (рис. 1). Исходное вещество помещают в фарфоровую или кварцевую лодочку, которую помещают в реактор (как правило, кварцевая трубка) и нагревают в токе водорода до нужной температуры. Водород для восстановления получают или в электролизёре, или в аппарате Киппа. Предварительно установку проверяют на герметичность. Для этого конец газоотводной трубки погружают на 4-5 см в воду и пропускают водород. Выделяющиеся пузырьки газа указывают на герметичность. Если источником водорода служит аппарат Киппа, герметичность установки можно проверить, перекрыв зажимом газоотводную трубку. Если установка герметична, реакция в аппарате Киппа прекратится и водород перестанет пробулькивать через промывочные склянки.
Рис. 1. Схема установки для восстановления оксидов водородом.
Перед нагреванием реактора воздух из него необходимо вытеснить водородом, после чего водород, выходящий из газоотводной трубки, собирают в пробирку и проверяют на чистоту. Только после этого трубку нагревают в токе водорода, пропуская его со скоростью 1-2 пузырька в секунду.
При восстановлении оксидов образуются пары воды. При восстановлении более устойчивых оксидов бóльшая часть паров воды уносится водородом в атмосферу. Если восстанавливаются непрочные оксиды (CuO, PbO и т.п.), то в конце трубки (реактора) собираются капельки воды. Поэтому в этом случае печь располагают с небольшим наклоном, чтобы конденсирующаяся вода не попадала на раскалённые части реактора.
При восстановлении водородом необходимо контролировать температурный режим, поэтому для измерения температуры используют термопару, которую располагают вне трубки (реактора) в непосредственной близости от лодочки.
При температуре 550-600 о С и ниже реакцию можно вести не в лодочке, а прямо в стеклянной трубке или в трубке с перетяжками. В такой реактор при помощи шпателя вводят 2-3 г оксида и нагревают его в токе водорода. Если полученный металл окисляется на воздухе, его следует по окончании реакции запаять в той же трубке. Для этого после охлаждения металла в токе водорода трубку отсоединяют от источника водорода, вынимают пробки, и оставляют её на 5-7 минут в наклонённом положении. Затем трубку запаивают.
Окончание реакции восстановления оксидов определить довольно трудно. Иногда об этом можно судить по изменению цвета или уменьшению массы оксида. Практически водород пропускают в избытке в течение 20-30 минут, после чего реакцию считают доведённой до конца.
После окончания реакции прибор охлаждают в токе водорода, отсоединяют газоподводящую трубку, вынимают лодочку, извлекают продукт реакции и при необходимости запаивают его в пробирке. Запрещается
разбирать прибор в горячем состоянии, так как воздух, попавший в реактор, может образовать с водородом взрывчатую смесь!
2.1.1. Получение молибдена (вольфрама)
Собрать прибор для получения металлов водородом (рис. 1). Тщательно проверить герметичность прибора. Взвесить в лодочке
1 г триоксида молибдена (вольфрама) и поместить лодочку с металлом в кварцевую трубку. Ещё раз проверить герметичность прибора. Заполнить установку водородом, проверить водород на чистоту ( как это сделать? ) и только после этого включить печь. Восстановление проводить при температуре 800-900 о С в токе сухого водорода ( чем можно осушать водород? ). Для получения крупнозернистого металла, не прерывая тока водорода, постепенно повысить
температуру до 1000-1000 о С (для вольфрама до 1200-1300 о С, в этом случае вместо кварцевого необходимо использовать стальной реактор). Когда восстановление закончится ( как в этом убедиться? ), охладить прибор в токе водорода до комнатной температуры.
Испытать отношение полученного металла к 10%-м и концентрированным растворам кислот и щелочей на холоду и при нагревании.
2.1.2. Получение пирофорного железа
Собрать прибор для получения металлов водородом (рис. 1). Проверить герметичность прибора. Тщательно растереть в агатовой ступке оксид железа(III), взвесить в лодочке
1 г оксида и поместить лодочку в реактор. Печь установить с небольшим наклоном в сторону газоотводной трубки ( зачем? ). Восстановление вести в токе водорода при температуре 400-500 о С в токе сухого водорода ( чем можно осушать водород? ). Когда восстановление закончится ( как в этом убедиться? ), охладить печь до 100 о С, вынуть лодочку и с некоторой высоты высыпать порошок железа в нагретую фарфоровую чашку. Что при этом происходит? Чем объясняется пирофорность железа?
2.2. Металлотермический метод
Металлотермическими реакциями называют реакции, протекающие между оксидами и металлами и приводящие к получению металла в сплавленном виде за счёт большого выделения теплоты в ходе реакции. Если же выделяющейся теплоты не хватает для расплавления продуктов, то металл получается в виде мельчайших капелек, т.е. в виде порошка.
Этот метод, открытый в 1856 г. Русским химиком Н.Н. Бекетовым, находит применение как в промышленности (например, магнийтермическое получение титана), так и для лабораторного получения металлов, сплавов и некоторых неметаллов.
достаточно для этого. В этом случае получается металл, который оседает на дно тигля.
При использовании в качестве восстановителей магния или кальция металлы получаются в виде порошка. Это можно объяснить тем, что образующийся оксид магния (или кальция) имеет высокую температуру плавления, поэтому во время реакции не расплавляется и изолирует друг от друга отдельные мельчайшие капли металла.
При проведении алюминотермических реакций необходимо соблюдать некоторые правила предосторожности. Алюминий берут в виде мелких крупинок. Порошкообразный алюминий (алюминиевая пудра) непригоден, так как с ним реакции протекают слишком бурно, происходит разбрызгивание смеси, что снижает выход получаемого металла.
Оксиды, а также реактор (тигель) необходимо просушить при 150-200 о С (так как при наличии влаги в ходе восстановления реакционная смесь разбрасывается). После этого оксиды растирают в порошок и отделяют на сите от неразмельчённых частичек. Высушенные и размельчённые исходные вещества отвешивают на технических весах и тщательно перемешивают. При проведении реакции следует брать не менее 25-30 г исходных веществ (суммарно). С бóльшими количествами веществ реакции идут ещё лучше и выход металлов увеличивается.
Масса алюминия должна быть равна теоретически рассчитанной. Чтобы получить металл или сплав без алюминия, следует брать его несколько меньше теоретически рассчитанного (на 1-2%).
В качестве восстановителя можно использовать смеси порошкообразных металлов, а также смеси металлов с кремнием, например:
4Cr 2 O 3 + 3Mg + 6Al = 8Cr + 3Mg(AlO 2 ) 2
Несмотря на то, что алюминат магния плавится при 2135 о С, т.е. выше, чем оксид алюминия, реакции со смесью восстановителей идут лучше. Это объясняется тем, что при использовании данной смеси металлов теплоты выделяется больше, чем при использовании одного алюминия. Например, алюминий оксид хрома(III) непосредственно не восстанавливает, а смесь алюминия с магнием или кальцием этот оксид восстанавливает.
Для проведения реакции нужна зажигательная смесь. Существует несколько рецептов приготовления зажигательной смеси:
1) 9 массовых частей растёртого пероксида бария смешивают с 1 м.ч. порошкообразного алюминия;
2) смешивают 3 м.ч. растёртого нитрата калия и 1.3 м.ч. алюминиевой пудры;
3) готовят смесь 4 м.ч. растёртого пероксида бария и 1 м.ч. порошкообразного алюминия и добавляют 0.7 м.ч. отдельно растёртого хлората калия. Зажигательную смесь хранят в сухой, хорошо закупоренной стеклянной банке; приготавливать её в больших количествах не рекомендуется.
В качестве реактора используют магнезиальные или корундовые тигли, так как
они термически стойки и вещества при работе с ними меньше загрязняются. Фарфоровые тигли, как правило, разрушаются. Поэтому их нужно помещать в песок, чтобы расплавленная масса не выливалась. Более удобны шамотовые или глиняные тигли, но в этом случае продукт загрязняется кремнием и другими веществами.
Лабораторный практикум по неорганическому синтезу (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
При расслаивании продуктов реакции на шлак и металл можно дать только приближенную оценку температуры. В действительности теплоемкости получаемых материалов несколько отличаются. Соотношение между массой металла и оксида алюминия меняется в зависимости от состава исходного оксида и атомной массы металла. Тепловые потери также меняются. При большом количестве шихты они меньше, а когда берут небольшие массы веществ (в лабораторных опытах), они больше.
Частичное разложение и испарение наблюдается при алюмотермическом восстановлении оксида хрома ( VI ) и оксида молибдена ( VI ). Эти оксиды также нельзя непосредственно использовать для алюмотермического получения металлов. Но их можно применять в качестве добавок к различным оксидам при получении сплавов.
Если реакционная масса в результате реакции нагревается недостаточно и выделяющегося тепла не хватает для расслаивания массы на металл и шлак, то применяют различные добавки, снижающие температуру плавления шлака и уменьшающие его вязкость, что облегчает расслаивание смеси на металл и шлак. Например, добавляют вещества, образующие с получаемым оксидом соединения или растворы. Так, фторид кальция предупреждает «запутывание» корольков в шлаке.
Часто к реакционной смеси добавляют различные окислители; при окислении части взятого в избытке металла-восстановителя выделяется тепло, за счет которого температура реакционной смеси повышается, и ее расслоение становится возможным. В качестве окислителей используют хлораты, нитраты, оксиды легко восстанавливаемых металлов, хотя нитраты мало используют, так как продукт легко загрязняется нитридом.
Cr2O3 + Fe2O3 + 4Al = 2Cr + 2Fe + 2Al 2O3
пройдет и сплав осядет на дно тигля.
При восстановлении оксидов алюминием металлы и неметаллы получаются в сплавленном виде и оседают на дно тигля. При использовании в качестве восстановителя магния и кальция металлы получаются в виде порошка. Это можно объяснить тем, что образующийся оксид магния имеет высокую температуру плавления, во время реакции не расплавляется и изолирует друг от друга отдельные мельчайшие капли металла.
При металлотермическом восстановлении металлов необходимо, чтобы точки кипения продуктов реакции были выше температуры, которая развивается в результате реакции. В ином случае, компонент смеси, имеющий низкую температуру кипения, испаряется и тем самым удаляется из сферы реакции. К числу таких низкокипящих металлов относятся калий, натрий, кадмий и цинк.
Легкая испаряемость исходных оксидов также затрудняет проведение реакции восстановления алюмотермическим путем. Легко испаряются оксиды молибдена и вольфрама ( VI ), их нужно брать в избытке. Оксид хрома ( VI ) не только легко испаряется, но и легко разлагается. Для уменьшения испарения оксида молибдена ( VI ), для снижения температуры реакционной смеси и облегчения выделения металла прибавляют плавни, например, фторид кальция.
При проведении алюмотермических процессов необходимо, чтобы оксиды восстанавливаемых металлов были негигроскопичными (например, оксиды щелочных и щелочноземельных металлов, оксид хрома ( VI )) и термически устойчивыми (диоксид марганца, оксид хрома ( VI )). В противном случае, реакции проходят с большими потерями из-за разбрасывания реакционной массы выделяющимися парами воды и кислородом.
6.2 Практическая часть
При проведении алюмотермических реакций необходимо соблюдать некоторые правила предосторожности. Алюминий берут в виде мелких крупинок. Порошкообразный алюминий, имеющийся в продаже под названием алюминиевой пудры, непригоден (он содержит окисленный металл). С неокисленным алюминием реакции протекают слишком бурно, происходит разбрасывание шихты, что снижает выход получаемого металла.
Реакцию проводить в вытяжном шкафу, откуда убрать все легковоспламеняющиеся материалы. Тигель поместить в песок. Работать в кожаных перчатках и защитных очках.
— подготовка исходных веществ и реактора;
— приготовление зажигательной смеси и заполнение реактора;
— проведение металлотермической реакции;
— разделение продуктов реакции.
При проведении реакции следует брать не менее 25 − 30 г исходных веществ (суммарно). С большим количеством веществ реакции идут лучше, и выход металлов увеличивается. Масса восстановителя (алюминия) должна быть равна теоретически рассчитанной массе.
Чтобы получить металл или сплав без алюминия, следует брать его несколько меньше теоретически рассчитанного на 1 – 2 %.
В качестве восстановителя можно использовать смеси порошкообразных металлов или смеси металлов с кремнием, например:
4Cr2O3 + 3Mg + 6Al = 8Cr + 3Mg(AlO2) 2
Приготовление зажигательной смеси и заполнение реактора. Зажигательную смесь готовят смешиванием 9 масс. ч. растертого пероксида бария с 1 масс. ч. порошкообразного алюминия. Можно использовать смесь, приготовленную из 4 масс. ч. растертого пероксида бария и 1 масс. ч. порошкообразного алюминия с добавлением 0,7 масс. ч. отдельно растертого хлората калия. Иногда берут 3 масс. ч. растертого нитрата калия и 1,3 масс. ч. алюминиевой пудры. Смешивать эти вещества нужно очень осторожно! Зажигательную смесь хранят в сухой, хорошо закупоренной стеклянной банке; приготовлять ее в больших количествах не рекомендуется.
Заполнение реактора шихтой. В качестве реактора используют магнезиальные или корундовые тигли, так как они термически стойки и вещества при работе с ними меньше загрязняются. Фарфоровые тигли, как правило, разрушаются. Поэтому их нужно помещать в песок, чтобы расплавленная масса не выливалась. Более удобны шамотовые или глиняные тигли, но в этом случае продукт несколько загрязняется кремнием и другими веществами.
Тигель 1 (рис.13) заполняют на ¾ его высоты смесью из оксида и восстановителя. Утрамбовывают массу, делают небольшое углубление и засыпают сверху тонким слоем (1 – 1,5мм) зажигательной смеси. Ленту магния вставляют в углубление, которое, которое затем заполняют зажигательной смесью в форме горки. Если лента магния покрыта слоем оксида, ее следует очистить ножом.
Меры предосторожности. Реакцию проводят в вытяжном шкафу, откуда убирают все легковоспламеняющиеся материалы. Тигель помещают в песок. Работают в защитных очках!
Проведение опыта. Зажигательную смесь поджигают при помощи магниевой ленты, которую можно поджечь длинной лучиной. Если имеются магниевые стружки, то можно поджечь магний, зажав стружки длинными тигельными щипцами, и бросить их на зажигательную смесь.
Разделение продуктов реакции. После окончания реакции тигель охлаждают, разбивают и «королек» металла отделяют от шлака. Иногда кусочки металла остаются в шлаке в виде включений. В этом случае шлак нужно разбить и отделить от него металл; кусочки шлака, приставшие к металлу, удаляют с помощью молотка на стальной плите.
Методики синтеза некоторых металлов.
Зажигательную смесь готовят встряхиванием в банке 6,75г BaO 2 c 0,75г Mg порошка. Тигель поставить в баню с песком. Опыт проводить в вытяжном шкафу (надеть очки, перчатки). Осторожно поджечь ленту магния длинной горящей лучиной. После вспышки дать остыть расплавленной массе, разбить тигель и вынуть королек металла.
Зажигательная смесь: 1вес. ч. (4г) порошка Al и 3 вес. ч. (12г) перекиси бария.
Приготовить смесь из порошкообразного Mn 2 O 3 / Mn 3 O 4 (готовится прокаливанием порошка MnO 2 в муфельной печи при 900оС), порошка Al и свежепрокаленной окиси кальция, который добавляют для уменьшения вязкости шлака и облегчения расслаивания реакционной массы, превращая Al 2 O 3 в алюминат кальция, а не в алюминат марганца.
Mn 3 O 4 : Al : CaO = 15 : 10 : 2,5 ( Mn 3 O 4 : Al : CaO = 7,5г : 5г : 1,25г)
Зажигательная смесь: 1 вес. ч.(2г) Al порошка и 3 вес. ч.(6г) перекиси бария.
1. Какое положение занимает алюминий в Периодической Системе? Написать электронную конфигурацию атома алюминия; какие степени окисления он может проявлять; каковы его валентные возможности?
2. В виде каких соединений алюминий встречается в природе; как его получают в промышленности?
3. Какое положение занимает алюминий в ряду напряжений металлов?
4. Как относится алюминий к кислороду воздуха, воде, кислотам, растворам щелочей? ем объяснить устойчивость алюминия к концентрированным растворам серной и азотной кислот?
5. Как получить из оксида алюминия: алюминат натрия, трихлорид алюминия?
6. Привести примеры комплексных соединений алюминия.
7. В каких условиях можно получить гидрид алюминия; какими свойствами он обладает?
8. В чем состоит сущность процесса алюмотермии?
6.4 Вопросы для самоконтроля к модулю 6
1. Как взаимодействует алюминий с: серой, углеродом, азотом, галогенами, фосфором?
2. Будет ли взаимодействовать металлический алюминий с растворами: поваренной соли, соды, соляной кислоты, сулемы, хлорной меди?
3. Как практически можно убедиться в том, что гидроксид алюминия обладает амфотерными свойствами?
4. Написать уравнение реакции гидролиза гидроксоалюмината калия.
5. Написать уравнения реакций получения: оксида алюминия из нитрата алюминия; сульфата алюминия из оксида алюминия.
6. Что обычно используют в качестве восстановителя при проведении алюмотермического восстановления оксидов?
7. Почему некоторые оксиды не восстанавливают алюмотермически, хотя термодинамически эти процессы возможны?
8. Какие меры предосторожности необходимо соблюдать в процессе алюмотермического восстановления оксидов?
9. Чем чаще всего может быть загрязнен металл, полученный алюмотермическим путем?
Проектное задание к модулю 6.
Провести синтез металла из его оксида алюмотермическим способом. Рассчитать практический выход. Написать уравнения реакций, отражающих химические свойства полученного вещества.
Тест рубежного контроля к модулю 6.
1. Какие из перечисленных оксидов можно восстанавливать алюмотермически?
г) V2O5, Fe2O3, Cr2O3
а) слишком большая скорость, разбрасывание реакционной смеси
б) слишком маленькая скорость реакции
в) частичное разложение или испарение оксидов
г) при реакции выделяется очень мало теплоты
3. Наиболее части в качестве восстановителя при металлотермии используют
г) кальций или магний
4. Чем может быть загрязнен основной продукт?
5. Какой состав зажигательной смеси используют при алюмотермии
6. Что лучше применять в качестве реактора?
а) корундовые тигли
б) стеклянные пробирки
г) фарфоровые тигли
3 Г. Брауэр. Руководство по препаративной неорганической химии. М.: «Мир», Т.1
8 Ахметов и неорганическая химия. М.: Высш. шк., 1988.
10 Некрасов общей химии. М.: Химия, 1972, 1973. Т.1,2.
11 Уилкинсон Дж. Современная неорганическая химия. М.: Мир, 1969. Ч. 1-3.