что лучше ремикейд или хумира
Что лучше хумира или ремикейд
Показания к применению моноклональных антител
Разработка моноклональных антител началась еще в 1975 году, и с тех пор лекарственные средства на их основе заняли значимое место в лечение многих сложнейших заболеваний:
Представители моноклональных антител
Ремикейд (Инфликсимаб)
Препарат Инфликсимаб, который имеет торговое название Ремикейд, применяется в качестве иммунодепрессанта при ревматоидном артрите и болезни Крона. Лекарство взаимодействует с фактором некроза опухоли, образуя с ним устойчивый комплекс. Это позволяет подавить воспалительный процесс в суставах или стенке кишечника. Используется инфликсимаб только совместно с метотрексатом, который уменьшает количество антител, а также способствует повышению концентрации моноклональных антител.
Ремикейд противопоказан при инфекционных заболеваниях, а также при беременности и кормлении грудью. Побочных эффектов при использовании Ремикейда достаточно много: депрессия, головная боль, тошнота, одышка, диспепсия, сыпь.
Применяется Ремикейд, только в условиях стационара. Это связано с тем, что вводится он внутривенно медленно (менее 2мл/мин), с помощью инфузомата. Первая доза инфликсимаба, при лечении ревматоидного артрита, составляет 3мг/кг массы тела (около 200 мг, что соответствует 2 флаконам препарата). Повторное использование проводится в той же дозировке через 2 и 6 недель после первого введения, и далее каждые 8 недель. Длительность терапии определяется лечащим врачом в каждом случае индивидуально.
Ремикейд входит в перечень жизненно необходимых лекарственных средств, и его фиксированная цена в России составляет 26 тысяч рублей за 1 флакон.
Хумира (Адалимумаб)
Препарат Хумира (компания AbbVie) – известное средство, активным веществом которого является моноклональное антитело адалимумаб, применяемое для лечения тяжелой формы ревматоидного и псориатического артрита, а также анкилозирующего спондилита.
Препарат представляет собой аналог IgG1 человека, который при применении связывается с фактором некроза опухоли (ФНО) и блокирует его. ФНО является основным белком, который разрушает суставные ткани, и вызывает в них воспалительную реакцию.
Применение Хумиры противопоказано при беременности и в период лактации, при рассеянном склерозе, в детском возрасте, а также при острых и хронических инфекционных заболеваниях. Побочные эффекты при использовании возникают часто:
Вводится Хумира только подкожно, обычно в область живота. Дозировка при лечении артритов составляет 40 мг (содержимое 1 флакона) 1 раз в 2 недели. При этом разрешается применение базисной терапии метотрексатом, кортикостероидами и НПВС.
Для лечения суставов наши читатели успешно используют СустаЛайф. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Цена препарата Хумира в России составляет 58 тысяч рублей, и он входит в перечень льготных лекарств. В связи с высокой стоимостью, купить Хумиру может не каждый, но существует индийский дженерик Exemptia (компания Zydus), за 18 тысяч рублей, который ничем не уступает оригиналу.
Актемра (Тоцилизумаб)
Препарат Актемра – это моноклональное антитело, которое подавляет интерлейкин-6 (ИЛ-6). За счет этого подавляется воспалительная реакция в суставных сумках пораженных ревматоидным артритом.
В ходе клинических исследований тоцилизумаб показал высокую эффективность при использовании в дозе 8мг/кг тела. Уже на 2 неделю от начала лечения больные отмечали значительное улучшение, что подтверждалось шкалой DAS28 и рентгенологически. Эффект от лечения сохранялся у большей части пациентов на протяжении 18 месяцев.
Препарат Актмера противопоказан в следующих случаях:
При применении тоцилизумаба очень часто наблюдались следующие побочные эффекты: инфекции верхних дыхательных путей, сыпь, зуд, головная боль, повышение артериального давления.
Цена препарата Актемра составляет всего 9 тысяч рублей, что в совокупности с высокой эффективностью и редкой периодичностью использования (1 раз в месяц), делает его одним из лучших средств для лечения тяжелых форм ревматоидного артрита.
Симпони (Голимумаб)
Препарат Симпони (компания Бакстер, США) – является человеческим моноклональным антителом, которое относится к классу IgG1k. Этот белок блокирует ФНО, тем самым значительно снижая активность воспалительного процесса в суставах, а также снижает выработку интерлейкинов 6 и 8, которые являются медиаторами воспаления. Применяется Симпони при тяжелых формах ревматоидного и псориатического артрита, которые не поддаются лечению метотрексатом и кортикостероидами.
Противопоказания к применению, а также побочные эффекты у больных получающих лечение голимумабом такие же, как у всех вышеуказанных лекарственных средств.
В ходе клинических исследований, были получены данные о высокой эффективности Симпони при лечении ревматоидного артрита, после однократного использования которого, уже на 4 неделе терапии отмечалось значительное улучшение. Голимумаб вводится подкожно в области живота или бедра, в дозе 50мг (содержимое 1 шприц-ручки). Кратность применения 1 раз в 2 недели.
Цена препарата Симпони составляет 61 тысячу рублей, но он входит в перечень ЖНВЛП, что позволяет его получать некоторым пациентам бесплатно.
Применение препарата Хумира: инструкция с видео, отзывы врачей и больных

Его применение намного облегчает течение болезни, а также уменьшает очаг воспаления и предотвращает его дальнейшее распространение на другие органы.
Выпускается в виде раствора, который имеет немного подкрашенную структуру. Раствор предназначен для подкожного введения, помещен в шприцы из бесцветного стекла объемом 0,8 мл. Шприцы помещены в блистеры, которые содержатся в упаковке из картонной основы. К шприцам прилагается спиртовая салфетка.
Особенности состава
В 0,8 мл средства содержатся следующие компоненты:
Фармакологические свойства
Хумира входит в группу средств селективного вида с иммунодепрессивным действием.
Активный компонент лекарственного средства – адалимумаб, связывается избирательным способом с фактором некроза опухоли (ФНО) и вызывает нейтрализацию его функции за счет блокировки взаимодействия с клеточными рецепторами.
Фактор некроза опухоли на высоком уровне в синовиальной жидкости возникает у больных с артритом ревматоидного типа, анкилозирующим спондилитом, псориатическим артритом.
Главной причиной возникновения воспалительного процесса и разрушения костных тканей, которые проявляются во время развития данных патологий, является фактор некроза опухоли.
Адалимумаб обуславливает изменение ответных биологических реакций, возникновение и регулирование которых происходит за счет ФНО, а также реакций, вызывающих миграцию лейкоцитов.
Медикамент при терапии пациентов, у которых диагностирован ревматоидный артрит, способствует снижению уровня показателей воспалительного процесса острофазного типа, а также вызывает снижение уровней цитокинов сывороточного типа.
Помимо этого, благодаря уменьшению сывороточной активности происходит снижение процесса ремоделирования и разрушительного процесса хрящевых тканей.
Фармакокинетика лекарства
Лекарственное средство достаточно медленно всасывается. Распределение действующего вещества занимает длительный период.
Максимальная концентрация медикамента достигается в среднем через 5 дней. В крови и внесосудистых жидкостях распределение лекарства происходит в равном количестве. Во время однократного подкожного введения лекарства в дозировке 40 мг уровень абсолютной биодоступности составляет 64 %.
Процесс выведения препарата из организма достаточно медленный, и в среднем варьируется между 10 и 20 днями.
При каких показаниях нужно применять
Уколы Хумира назначаются при следующих состояниях:
Когда и кому средство противопоказано
Препарат Хумира запрещено применять в следующих случаях:
Как правильно поставить укол
Медикамент Хумира применяется взрослыми пациентами при помощи подкожного введения. Раствор вводится по 40 мг один раз в 14 дней.
Если во время этого проводится терапевтическое лечение с использованием ГКС, анальгетиков, Метотрексата, НПВС, салицилатов, и других аналогичных препаратов, то оно может продолжаться.
Пошаговая инструкция по применению средства Хумира:
Как самостоятельно поставить укол средства Хумира — видеопособие:
Использование во время беременности и на грудном вскармливании

Для лечения суставов наши читатели успешно используют СустаЛайф. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Тем не менее лекарственное средство Хумира не рекомендуется применять во время беременности и при грудном вскармливании. Женщинам репродуктивного возраста не нужно планировать зачатие при использовании лекарства.
В связи с тем, что активный составляющий элемент лекарственного средства может попасть в состав молока, его нельзя применять во время кормления грудью. Это связано с тем, что он может оказать вредное влияние на ребенка.
Симптомы передозировки и побочные эффекты
Случаев передозировки во время применения даже максимальных доз Адалимумаба не выявлено, но во время применения больших доз лекарства необходимо внимательно следить за состоянием больного и при обнаружении первых симптомов передозировки следует произвести симптоматическое лечение.
Среди многочисленных побочных явлений могут отмечаться следующие состояния:
Современная точка зрения
Отзывы практикующих врачей и больных, которые делали инъекции препарата Хумира помогут прояснить ситуацию с эффективностью и безопасностью средства.
Цена кусается
Цена одного шприца Хумира с дозировкой 40 мг составляет от 24 000 до 34 000 тысяч рублей, стоимость шприца № 2 с дозировкой 80 мг начинается от 48 000 до 77 000 рублей, для покупки также доступны аналоги:
Генно-инженерные биологические препараты в лечении увеитов, ассоциированных с ревматическими заболеваниями, у детей
Увеит (воспаление сосудистой оболочки глаза) – одно из наиболее частых и тяжелых экстраартикулярных проявлений ревматических заболеваний (РЗ) у детей, прежде всего ювенильного идиопатического артрита (ЮИА). Увеит возникает у 12–24% детей с ЮИА, частота развития осложнений достигает 80%, 7–12% пациентов становятся слепыми [1–5]. Из-за недостаточной эффективности местного противовоспалительного лечения увеита в большинстве случаев назначают системную терапию. Основными препаратами системного лечения увеитов остаются глюкокортикостероиды (ГКС), циклоспорин A и метотрексат. Однако их эффективность даже при комбинированном применении не превышает 48–71%, а применение нередко сопровождается развитием побочных реакций [1–3, 6, 7].
Результатом изучения молекулярных механизмов патогенеза иммуноопосредованных заболеваний стало появление в клинической практике в конце 1990-х гг. генно-инженерных биологических препаратов (ГИБП) – полученных генно-инженерным путем препаратов моноклональных антител против отдельных детерминант иммунокомпетентных клеток, молекул адгезии, цитокинов и их рецепторов. Это позволило проводить целенаправленную и вместе с тем мощную иммуносупрессивную терапию, что имело революционное значение в лечении различных аутоиммунных и аутовоспалительных заболеваний. В ходе многочисленных исследований установлена эффективность ГИБП при ЮИА [8, 9]. Однако их влияние на течение ассоциированного увеита изучено в небольших группах пациентов, а полученные результаты значительно варьируют [10–24]. Между тем общепризнанным считается частое отсутствие корреляции тяжести течения и активности увеита и суставного синдрома, а также их ответа на базисную терапию [2, 3].
Целью исследования стало изучение эффективности ГИБП в лечении ассоциированных с РЗ увеитов у детей.
Материалы и методы
Под наблюдением находились 110 детей (82 девочки, 28 мальчиков) в возрасте от 2 до 17 лет с увеитом, ассоциированным с РЗ, преимущественно с олигоартикулярным и полиартикулярным субтипами ЮИА (табл. 1).
Назначение ГИБП было инициировано ревматологами ведущих научно-исследовательских учреждений Москвы: к.м.н. И.П. Никишиной (детское отделение НИИ ревматологии РАМН), профессором Е.И. Алексеевой (отделение ревматологии Научного центра здоровья детей РАМН), профессором Н.А. Геппе (университетская детская клиническая больница Первого МГМУ им. И.М. Сеченова). Дети наблюдались по поводу основного заболевания. Показанием к применению ГИБП стала недостаточная эффективность традиционной терапии системного процесса или ее плохая переносимость и развитие побочных эффектов.
ГИБП назначали по стандартным схемам, применяемым в ревматологии. Большинство пациентов получали ингибиторы фактора некроза опухоли альфа (ФНО-альфа).
Инфликсимаб (Ремикейд ® ) – препарат химерных иммуноглобулинов G1 (IgG1) моноклональных антител к ФНО-альфа – получали 52 пациента в дозе 2,5–12,5 мг/кг (в среднем – 6,7 мг/кг) внутривенно по схеме: 0-я, 2-я, 6-я неделя, далее – каждые 8 недель. Период наблюдения – от 2 до 49 месяцев (в среднем – 11,3 ± 10,4 месяца). Двум детям группы инфликсимаба ранее проводилось лечение этанерцептом (Энбрел), на фоне которого был выявлен дебют увеита.
Адалимумаб (Хумира ® ) – препарат моноклональных антител к ФНО-альфа, идентичных IgG1 человека, – получали 57 пациентов (55 – с различными субтипами ЮИА, 2 – с болезнью Бехчета) в дозе 40 мг/м2 подкожно каждые 2 недели. Период наблюдения – от 3 до 52 месяцев (в среднем – 17,3 ± 14,1 месяца). 38 детям адалимумаб назначали в качестве первого ГИБП, 15 пациентам ранее проводилось лечение инфликсимабом, 2 детям – этанерцептом, на фоне которого в одном случае отмечались манифестации увеита, в другом наблюдался персистирующий воспалительный процесс в глазу, 1 ребенку – абатацептом, в период применения которого был отмечен дебют увеита.
Этанерцепт (Энбрел) – препарат, содержащий растворимые p75-рецепторы к ФНО-альфа, связанные с Fc-фрагментом IgG1 человека, – был назначен 6 пациентам (5 – без увеита, 1 – с активным воспалительным процессом в глазу) подкожно 0,4 мг/кг 2 раза в неделю.
Ритуксимаб (Мабтера ® ) – препарат химерных моноклональных антител, связывающихся с трансмембранным антигеном CD20 на В-лимфоцитах, – назначался 4 детям в дозе 375 мг/м2 внутривенно еженедельно № 4. Два ребенка ранее получали инфликсимаб, 1 пацент – адалимумаб. Одному пациенту был проведен 1 курс, 2 детям – 2 курса лечения с интервалами 4 и 8 месяцев, 1 ребенку – 3 курса лечения с интервалом 6 месяцев.
Абатацепт (Оренсия ® ) – блокатор костимулирующего сигнала активации Т-лимфоцитов, экспрессирующих CD28, – назначался 25 детям в дозе 10 мг/кг внутривенно по схеме: 0-я, 2-я, 4-я неделя, далее – каждые 4 недели. 9 пациентов ранее получали другие ГИБП: 6 детей – инфликсимаб, 1 ребенок – адалимумаб, 1 пациент – последовательно инфликсимаб и адалимумаб, 1 ребенок – инфликсимаб, ритуксимаб и адалимумаб. Длительность наблюдения на фоне терапии абатацептом – от 3 до 28 месяцев (в среднем – 12,9 ± 7,7 месяца).
Тоцилизумаб (Актемра ® ) – препарат гуманизированных моноклональных антител к рецептору интерлейкина-6 – в дозе 8,3 мг/кг внутривенно 1 раз в 4 недели назначали 1 ребенку с неэффективностью предшествующей терапии инфликсимабом, ритуксимабом, адалимумабом и абатацептом. Длительность наблюдения – 25 месяцев. Таким образом, 26 пациентов получали в период наблюдения от 2 до 5 ГИБП.
ГИБП применяли, как правило, в составе комплексной системной терапии. Обычно их сочетали с метотрексатом, его комбинацией с циклоспорином или небольшими дозами глюкокортикостероидов (табл. 2). В период активности увеита назначали местную противовоспалительную терапию: инстилляции ГКС и нестероидных противовоспалительных препаратов (НПВП), при тяжелом течении заболевания – периокулярные инъекции ГКС.
Эффективность лечения оценивали по динамике воспалительного процесса в глазу и частоте рецидивов увеита. Анализировали данные комплексного офтальмологического обследования [1, 2, 25]. Тяжесть воспалительного процесса в глазу на момент назначения ГИБП значительно варьировала и определялась на основании суммарной оценки выраженности и распространенности воспалительного процесса. В тяжелых случаях наблюдались интенсивная «запотелость» эндотелия роговицы, множественные преципитаты, клеточная реакция в передней камере (3–4-й степени), отек радужки с формированием задних синехий или заращением зрачка, клеточная реакция в стекловидном теле, папиллит и макулярный отек.
Увеит средней тяжести протекал с менее выраженными изменениями роговицы (умеренная «запотелость» эндотелия, немногочисленные преципитаты), экссудацией в переднюю камеру (количество клеток 2-й степени), отеком радужки, клеточной реакцией в стекловидном теле, папиллитом и/или макулярным отеком.
При легком течении заболевания отмечалась небольшая «запотелость» эндотелия, единичные преципитаты, клетки в передней камере 1-й степени, немногочисленные клетки в стекловидном теле или их отсутствие, нормальная картина глазного дна.
Ремиссией считали отсутствие клинических признаков активного воспалительного процесса от 1,5–2 месяцев до окончания периода наблюдения на фоне проводимой терапии. При двустороннем увеите и воспалительном процессе различной тяжести (частоте обострений) учитывали состояние «худшего» глаза.
Длительность заболевания увеитом до начала биотерапии у 99 детей составила от 1 месяца до 12 лет, у 11 пациентов его манифестации отмечались на фоне применения ГИБП. У большинства пациентов с ЮИА (103 ребенка из 108, 95,4%) воспалительный процесс протекал по типу иридоциклита, реже – панувеита (3 ребенка, 2,8%) или периферического увеита (2 пациента, 1,8%). У детей с болезнью Бехчета наблюдался панувеит. Как правило, заболевание глаз было двусторонним (84 ребенка, 76,4%).
До назначения ГИБП в 63 (57,2%) случаях, несмотря на проводимую традиционную иммуносупрессивную терапию 1–3 препаратами, увеит носил хронический характер или обострения воспалительного процесса кратковременно купировались только на фоне периокулярных инъекций и/или частых (6–8 раз в день) инстилляций ГКС и при уменьшении местной терапии возникали вновь. Еще в 17 (15,5%) случаях ГИБП назначались в ранние (до 2 месяцев) сроки после дебюта увеита.
При включении в схему терапии инфликсимаба ремиссия увеита отмечена у 13 (31%) из 42 пациентов с активным воспалительным процессом на момент начала лечения. Еще в 6 (14,3%) случаях наблюдалось уменьшение частоты и тяжести рецидивов, но стойкой ремиссии не наступало. Ремиссия увеита достигнута в том числе у одного ребенка с манифестацией увеита на фоне терапии этанерцептом, однако у другого ребенка назначение инфликсимаба не привело к купированию воспалительного процесса в глазу. Только у половины пациентов (6 детей (46,2%) из 13) после наступления ремиссии увеита удалось отменить местную противовоспалительную терапию. В остальных случаях для поддержания такого состояния потребовались инстилляции ГКС и/или НПВП от 1 до 3 раз в день.
Прослежена связь между эффективностью терапии инфликсимабом и тяжестью увеита до начала лечения (табл. 3). В то же время четкой связи между результатами лечения увеита и дозой препарата в анализируемой группе пациентов не выявлено.
У одной пациентки, находившейся под нашим наблюдением более 12 месяцев, с наступлением ремиссии увеита на фоне лечения инфликсимабом возникло обострение через 25 месяцев после начала терапии с последующим рецидивирующим течением воспалительного процесса в глазу.
У 6 детей в период назначения инфликсимаба увеит находился в стадии ремиссии. На фоне применения препарата в течение 23,5 месяца рецидив воспалительного процесса выявлен у 1 ребенка через 1,5 месяца после начала терапии. Однако увеит быстро (в течение 1 месяца) купировали инстилляциями ГКС и НПВП, и на протяжении последующих 6 месяцев на фоне только прежней системной терапии (метотрексат, инфликсимаб) обострений воспалительного процесса зарегистрировано не было.
Интересно, что у 4 детей, несмотря на лечение системного процесса инфликсимабом, наступил дебют увеита. Это были пациенты младшего возраста (2,5–4 года), с ранним и относительно недавним (2 месяца – 3 года) дебютом суставного синдрома, что позволяет отнести их к группе высокого риска развития тяжелого увеита. При этом воспалительный процесс в глазу в 3 случаях был легким, в 1 случае – средней тяжести, что может быть обусловлено влиянием препаратов (метотрексат, инфликсимаб, у 1 ребенка – в комбинации с циклоспорином). У одного ребенка из двух детей, которым терапия инфликсимабом была продолжена после манифестации увеита, наступила ремиссия воспалительного процесса, у другого – увеит рецидивировал в течение последующих 12 месяцев (срок применения препарата).
При назначении адалимумаба ремиссия достигнута у 22 детей (43,1%) из 51 пациента с активным ЮИА-ассоциированным увеитом, улучшение отмечено еще у 21 ребенка (41,2%). У 4 детей в период назначения препарата увеит находился в стадии стойкой ремиссии, на фоне терапии в течение 3–18 месяцев обострений воспалительного процесса не наблюдалось.
Как и в отношении инфликсимаба, прослежена связь между результатами лечения и тяжестью воспалительного процесса в глазу: ремиссия и улучшение при легком течении увеита регистрировались значительно чаще, чем при среднетяжелом и тяжелом, эффективность терапии при которых существенно не отличалась (табл. 4). Установлено, что частота наступления ремиссии при применении адалимумаба достоверно выше, чем при введении инфликсимаба (43,1 и 31% соответственно, р
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 2. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 8. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
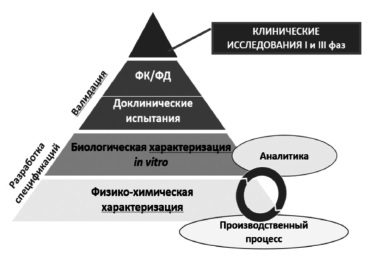
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 16 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.






