что лучше цефепим или цефотаксим
Цефепим: при каких заболеваниях рекомендуется купить
Антибактериальное средство нового поколения, действенное против патогенов широкого спектра. Применяется по назначению врача в стационарных и амбулаторных условиях короткими курсами, редко вызывает резистентность микробов.
Состав и лекарственная форма
Медикамент имеет единственную фармацевтическую форму — порошок для приготовления внутримышечных и внутривенных инъекций. Лекарства для приема перорально не существует. Сухая смесь содержит активный компонент — цефепима гидрохлорид, который относится к антибактериальным средствам цефалоспоринового класса. Это четвертое поколение веществ, оказывающих более быстрый и долговременный терапевтический эффект.
Микрокристаллический порошок белого цвета расфасован в стеклянные флаконы. Одна доза содержит 0,5 или 1 г. цефалоспорина и стабилизирующие добавки. Перед использованием препарат необходимо разводить дистиллированной водой, физраствором или лидокаином.
Механизм действия
Цефепим, проникая в кровь и мягкие ткани, оказывает выраженное бактерицидное действие: разрушает клеточные мембраны и белки грамположительных, а также грамотрицательных бактерий. Препарат не дает возможности патогенам приспособиться к лекарственному веществу и выработать к нему устойчивость, уничтожая их уже при первом контакте.
Цефепим оказывается эффективным там, где не действуют аминогликозиды и антибиотики других групп. Его назначают при инфицировании стрептококками, клебсиеллами, протеем, клостридиями и другими видами болезнетворной микрофлоры.
Показания к использованию
Лекарственное средство назначают:
при бактериальной пневмонии: средней и тяжелой степени тяжести, если патология вызвана чувствительными к цефалоспоринам микробами;
при фебрильной нейропении;
при инфекционных поражениях почек и воспалениях мочевыводящих путей, протекающих осложненно или без серьезных осложнений;
при кожных инфекциях, а также при воспалениях прилегающих к ним мягких тканей;
при инфекционных процессах органов брюшной полости и малого таза: в составе комплексного лечения, в сочетании с другими антибиотиками.
При необходимости Цефепим применяют в педиатрической практике: с возраста 2 месяцев.
Противопоказания
Отказаться от терапии препаратом необходимо при индивидуальной повышенной чувствительности к его компонентам. Она может проявляться покраснением кожи, пятнами, крапивницей, отечностью покровов и слизистых оболочек, раздражением, усиленным зудом. В тяжелых случаях развивается отек Квинке.
возраст младше 2 месяцев;
язвенная болезнь желудка и язвенный колит в стадии обострения;
тяжелая почечная недостаточность;
хронические нарушения системы кроветворения;
Побочные действия
На фоне использования антибиотика вероятны нежелательные реакции со стороны различных систем организма:
болезненность в месте постановки уколов;
головные боли, головокружения;
функциональные нарушения в работе почек;
тошнота, боли и спазмы в области желудка, запоры, метеоризм;
снижение количества тромбоцитов, лейкопения, снижение свертываемости крови;
аритмические проявления, скачки артериального давления;
физическая слабость, сонливость в дневные часы;
загрудинные и спинные боли.
При резком ухудшении самочувствия вопрос о продолжении лечения обсуждается с медицинским специалистом. При признаках непереносимости препарат отменяют.
Как применять Цефепим
Для приготовления внутривенных раствора содержимое флакона разводят с физиологическим раствором или дектрозой до исчезновения осадка. При внутримышечном введении порошок смешивают с водой для инъекций с содержанием спирта и других добавок. Допускается также соединение антибиотика с раствором лидокаина. Лекарство запрещено соединять в одном шприце или капельной системе с другими антибактериальными средствами.
Однократная доза медикамента составляет от 0,5 до 2 г, в зависимости от вида заболевания.
Внутривенные инфузии и уколы применяют преимущественно при лечении средних и тяжелых форм пневмонии, инфекций мочеполовой системы, фебрильной нейтропении. Начальные суточные дозы при этом максимальны: до 2 г. в сутки. В последующие дни допускается снижать дозировку до 0,5 г.
Внутримышечно Цефепим используют реже, обычно при неосложненных инфекциях внутренних органов, при лечении кожных заболеваний, в педиатрической практике.
Продолжительность курса определяют индивидуально. Для полного подавления инфекционного процесса требуется от 7 до 10 суток. Не допускается самовольное прерывание инъекций, так как это может спровоцировать дальнейшее развитие резистентности микробов и трудности с выбором подходящих медикаментов.
Цефепим несовместим с препаратами, содержащими гепарин. При назначении страдающим нарушениями почек требуется врачебный контроль за физическим состоянием и лабораторными показателями.
Аналоги и стоимость
Аналогичные Цефипиму антибактериальные препараты класса цефалоспоринов четвертого поколения: Максипим, Эфипим, Ладеф, Мовизар, Ценим.
Купить медикамент в аптечных сетях можно по цене от 100 до 200 рублей за один флакон.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Что лучше: Цефотаксим или Цефепим
Цефотаксим
Цефепим
Исходя из данных исследований, Цефепим лучше, чем Цефотаксим. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Цефотаксима и Цефепима
У Цефепима эффективность больше Цефотаксима – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Цефепима более выраженный, то у Цефотаксима даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Цефепима и Цефотаксима тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Цефотаксима и Цефепима
Безопасность препарата включает множество факторов.
При этом у Цефепима она выше, чем у Цефотаксима. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Цефепима, также как и у Цефотаксима мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Цефепима рисков при применении меньше, чем у Цефотаксима.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Цефепима и Цефотаксима.
Сравнение противопоказаний Цефотаксима и Цефепима
Исходя из инструкции. Количество противопоказаний у Цефотаксима достаточно схоже с Цефепимом и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Цефотаксима и Цефепима может быть нежелательным или недопустимым.
Сравнение привыкания у Цефотаксима и Цефепима
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значениий таких параметров, как «cиндром отмены» и «развитие резистентности», у Цефепима меньше, чем аналогичные значения у Цефотаксима. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной.
Сравнение побочек Цефотаксима и Цефепима
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Цефотаксима состояния нежелательных явлений почти такое же, как и у Цефепима. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Цефотаксима схоже с Цефепимом: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Цефотаксима и Цефепима
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Цефотаксима лучше, чем у Цефепима.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-13 10:32:38
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Стратегические подходы к выбору цефалоспориновых антибиотиков при инфекциях дыхательных путей
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказыва
 |
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказывается недостаточно. Фактор удобства приема препарата и, что особенно непривычно для нашего понимания, вопросы цены и стоимости лечения в условиях серьезного ограничения финансирования здравоохранения часто могут оказаться определяющими. На приобретение лекарственных средств лечебные учреждения тратят 15–20% своего бюджета, причем 50–60% этих расходов приходится на долю антибактериальных препаратов, что заставляет пересмотреть существующие и искать новые подходы к их применению.
Путаница, возникающая при использовании различных антибактериальных препаратов, в том числе и цефалоспориновых антибиотиков (ЦА), связана с недопониманием или просто незнанием основных принципов клинической химиотерапии. В связи с этим мы хотели бы остановиться на некоторых ошибках и «заблуждениях» практикующих врачей, возникающих при назначении антибактериальных препаратов, на примере ЦА, а также определить их место в лечении инфекции дыхательных путей.
Часто от практикующих врачей приходится слышать о безусловных преимуществах IV поколения препаратов перед III, III поколения перед II и т. д. Это абсолютно неверно. Такая точка зрения приводит к использованию «резервных» и мощных препаратов при лечении банальной инфекции, способствует развитию резистентности, а значит, лишает возможности применять препараты первых поколений и, наконец, вызывает значительное и неоправданное увеличение стоимости курса лечения.
ЦА занимают одно из важных мест в лечении инфекций верхних и нижних дыхательных путей. Наиболее ответственным этапом в антибактериальной терапии данной категории пациентов является выбор первоначального препарата. От адекватности выбора зависит эффективность и безопасность лечения, а также его комфортность, переносимость, стоимость, эпидемиологическая ситуация.
Анализ имеющихся данных об использовании ЦА в России за 1997–1998 гг. позволяет выявить предпочтения врачами того или иного препарата (группы препаратов) и определенных методов его введения. Как видно из рис. 1, при назначении цефалоспориновых антибиотиков подавляющее большинство врачей выбирают парентеральные препараты.
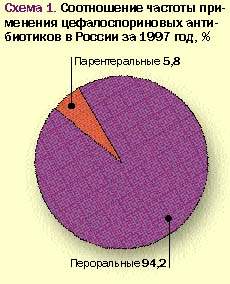 |
Данный факт лишь подтверждает, что в нашей стране пероральные лекарственные средства, и особенно пероральные цефалоспорины, очень мало популярны и практически не используются. Такое отношение к таблетированным формам отражает некоторый консерватизм практических врачей, связанный с тем, что еще 15-20 лет назад существовавшие тогда пероральные средства не выдерживали сравнения с парентеральными препаратами ни по эффективности терапии, ни по ее переносимости. Лишь последние десятилетия с момента создания первого перорального цефалоспорина — цефалексина и появления новых пероральных бактерицидных препаратов эта лекарственная форма несколько укрепила свои позиции не только в амбулаторной, но и в стационарной практике. Однако радикально на положении дел это не сказалось.
Очевидно, что такая форма назначения препаратов имеет безусловные преимущества. Это проявляется и в возможности амбулаторного ведения больного, и в удобстве приема препарата, и в снижении риска постинъекционных осложнений и длительности пребывания в стационаре, и даже в избавлении от психологического дискомфорта, связанного с инъекциями.
Наличие антибактериальных препаратов в двух формах — для парентерального и перорального применения — делает возможным их использование для проведения так называемой ступенчатой терапии. Суть такого лечения состоит в назначении внутривенного или внутримышечного препарата и в последующем, через двое-трое суток после достижения клинического эффекта, переводе на пероральный прием. Возможность проведения ступенчатой терапии одним и тем же препаратом является существенным преимуществом данного лекарственного средства перед его аналогами. Ступенчатая терапия предоставляет клинические и экономические преимущества как пациенту, так и лечебному учреждению.
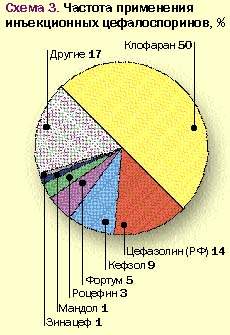
На основании приведенных данных трудно понять логику выбора цефалоспоринового антибиотика того или иного поколения и принципы, которыми руководствуется врач при назначении препарата. Анализ использования цефалоспориновых антибиотиков по поколениям (см. рис. 2 и 3) свидетельствует о предпочтительном назначении препаратов I и III поколений, причем из препаратов III поколения (61%) половина приходится на цефотаксим, а из препаратов I поколения большая часть приходится на цефазолин.
 |
В клинической практике врач начинает проводить антибактериальную терапию, в большинстве случаев не имея результатов микробиологической верификации инфекционного агента, а зачастую и без перспектив получения такого рода данных. Поэтому при выборе антибактериального препарата по-прежнему приходится ориентироваться на сведения, полученные из литературы, данные микробиологического мониторинга, а также на особенности клинической ситуации. Все это позволяет с большей или меньшей долей вероятности определить этиологический инфекционный агент с учетом клинической формы инфекции дыхательных путей (пневмония, хронический бронхит, синусит и т. д.), возраста (дети, старики), сопутствующих заболеваний (сахарный диабет, хроническая алкогольная интоксикация, лечение глюкокортикоидами и цитостатиками). Необходимо также иметь в виду особенности развития инфекции в амбулаторных условиях или в стационаре (лечение по поводу другого заболевания, пребывание в реанимации) при соответствующей эпидемиологической ситуации. Следует отметить, что при выборе препарата важно отличать «госпитальную», или нозокомиальную инфекцию, возникшую спустя двое суток после поступления в стационар, от «амбулаторной» инфекции, долечиваемой в стационаре. В последнем случае тактика антибактериальной терапии должна существенно отличаться.
Таким образом, ориентировочная этиология бронхолегочной инфекции служит основанием для выбора среди ЦА конкретного препарата (или поколения препаратов) с соответствующей антимикробной активностью.
У больных с амбулаторной инфекцией верхних и нижних дыхательных путей, основными возбудителями которых являются стрептококки, Н. influenzae, Moraxella catarrhalis, — препаратами выбора могут быть ЦА I или II поколения. В амбулаторных условиях предпочтение следует отдавать оральным цефалоспоринам (цефаклор, цефуроксим аксетил, цефтибутен). В то же время необходимо иметь в виду недостаточную активность ЦА в целом в отношении атипических бактерий (8–35% в этиологии «домашней» пневмонии) и некоторых анаэробных микроорганизмов, вероятность влияния которых увеличивается у больных с хроническими синуситами и отитами.
При обострениях хронического бронхита особое значение приобретают препараты, высокоустойчивые к действию b-лактамаз, продуцируемых как грамотрицательными, так и грамположительными микроорганизмами (цефуроксим аксетил), и обладающие высокой активностью против Н.influenzae (цефтибутен).
 |
При выявлении показаний для госпитализации больных с «домашней» инфекцией, подразумевающих более тяжелое течение, чаще обнаруживаются Streptococcus pneumonia, Staphylococcus aureus, Н.influenzae и Еntеrobacteriacea. В этом случае более обосновано назначение парентеральных цефалоспоринов II поколения (цефуроксим, цефамандол). Однако именно в таких ситуациях чаще всего и допускаются ошибки: при госпитализации больного в стационар с «домашней» пневмонией нередко назначают бензилпенициллин, аминопенициллины и ЦА I поколения (малоэффективные ввиду высокой резистентности патогенной флоры), либо, для «перестраховки» и при наличии в стационаре, ЦА III поколения (цефотаксим, реже цефтриаксон). Однако более обосновано — и это определяется спектром активности препарата — назначение ЦА II. Среди больных, получающих терапию в стационаре по поводу инфекций нижних дыхательных путей, преобладают нетяжелые случаи. Поэтому идеология назначения ЦА II поколения в качестве «стартовых» препаратов должна доминировать как с позиции адекватной клинической эффективности, экономической целесообразности, так и с позиции сохранения резерва в более тяжелых ситуациях.
Выбор ЦА в качестве первоначального антибиотика при внебольничной пневмонии у больных моложе 60 лет без сопутствующей патологии следует считать, по-видимому, не всегда оправданным. Это обусловлено этиологически широким спектром пневмоний в данной ситуации, который может включать не только пневмококки и Н.influenzae, но и так называемые атипичные возбудители — Мусорlаzma pneumоniaе, Legionella, Chlamidia pneumоniaе, которые не чувствительны к цефалоспоринам всех генераций. Между тем рациональная эмпирическая антибактериальная терапия бронхолегочных инфекций, в том числе пневмоний, должна предусматривать выбор препарата, по возможности активного против всех вероятных в данной ситуации возбудителей. К сожалению, сегодня трудно назвать препарат, полностью удовлетворяющий этим требованиям, за исключением нового поколения фторхинолонов или «респираторных» фторхинолонов. Некоторые из них — например, грепафлоксацин — проходят сейчас в нашей стране регистрацию. В случаях назначения ЦА при данном варианте пневмоний предпочтение следует отдавать ЦА I и II поколения. Применение в подобных ситуациях ЦА III поколения нерационально ввиду высокого риска развития резистентности. Выбор конкретного препарата среди ЦА I–II поколения должен осуществляться исходя из преимущества лекарственных форм, фармакокинетических свойств, стоимости и др. При нетяжелых пневмониях возможно назначение оральных цефалоспоринов. При этом необходимо иметь в виду их различную противомикробную активность по отношению к различным микроорганизмам. Так, например, цефтибутен обладает наибольшей активностью в отношении Н.influenzae, а цефуроксим аксетил — в отношении S.аureus.
Общие принципы выбора первоначального ЦА сохраняются и у больных пневмонией на фоне тяжелых сопутствующих заболеваний (ХОЗЛ, сердечная недостаточность, сахарный диабет, алкогольная интоксикация и др.) и в возрасте старше 60 лет. Этиологическое значение в данной клинической ситуации приобретают Н.influenzae, S.аureus, некоторые грамотрицательные микроорганизмы (Е.соli, Сlebsiella), возрастает частота бета-лактамазопродуцирующих бактерий. В связи с этим возрастает значение препаратов, активных в отношении названных возбудителей. Известно, что противомикробное действие ЦА при переходе активности от первого поколения к последующим характеризуется снижением противостафилококковой активности и преобладанием активности против некоторых грамотрицательных микроорганизмов. Ценным свойством является устойчивость ЦА II поколения к b-лактамазам. В связи с этим врач должен ориентиро-ваться в данной ситуации на цефалоспорины II или по крайней мере III поколения.
Иной подход, определяющий выбор ЦА для лечения бронхолегочной инфекции, наблюдается у больных с «госпитальной» инфекцией. Госпитальные пневмонии занимают особое место среди всех внутрибольничных инфекций из-за тяжести течения и трудностей терапии. Основными возбудителями госпитальных пневмоний являются грамотрицательные микроорганизмы семейства Еntеrobacteriacea — Сlebsiella, Protei, Enterobacter, Providencia, Serracia, а также Staphylococcus аureus, как чувствительный, так и устойчивый к метициллину. Вероятность этиологической роли того или иного инфекционного агента при госпитальных пневмониях определяется особенностями клинической ситуации (послеоперационный период, пребывание в реанимации, искусственная вентиляция легких и т. д.). У больных реанимационных и ожоговых отделений, с иммунодефицитами и муковисцидозом основным микроорганизмом бактериальных осложнений является синегнойная палочка, выявляемая в 70–95% случаев. Наряду с ней у таких больных высевается золотистый стафилококк или гемофильная палочка, устойчивая к ЦА II–III поколения. Основное место в лечении госпитальных пневмоний среди ЦА занимают препараты III (цефтазидим, цефоперазон) и IV поколений (цефпиром, цефепим). С учетом вероятности этиологической роли Pseudomonas aeruginoza в соответствующих ситуациях (ИВЛ, наличие трахеостомы, предшествующая глюкокортикоидная терапия) назначаемые ЦА должны обладать антисинегнойной активностью. Среди имеющихся в распоряжении врача ЦА наибольшей активностью в отношении Pseudomonas aeruginoza обладают цефалоспорины III поколения (цефтазидим, цефоперазон) и IV поколения (цефпиром), которые, однако, не имеют серьезных преимуществ в отношении синегнойной палочки перед цефтазидимом. Появление в терапевтическом арсенале ЦА IV поколения расширяет возможности антибактериальной терапии госпитальных пневмоний с высокой вероятностью грамотрицательной флоры, в том числе золотистого стафилококка, и могут рассматриваться как препараты ургентных ситуаций.
| Цефалоспорины, открытые более 50 лет тому назад, продолжают занимать прочные позиции в лечении различных бактериальных заболеваний, несмотря на появление новых антимикробных средств. Цефалоспориновые антибиотики подразделяются на четыре поколения, отличающиеся по спектру действия, антибактериальной активности, стабильности в присутствии b-лактамаз, фармакокинетическому профилю. Все это наряду с многообразием лекарственных форм и стоимостью определяет их различные показания. Очевидно, что по мере появления новых поколений цефалоспориновых антибиотиков в клинической практике возникает немаловажная проблема дифференцированного назначения препарата с учетом свойств как самого антибиотика, так и особенностей инфекционно- воспалительного процесса у конкретного больного |
Таким образом, рациональный выбор первоначального ЦА для лечения инфекций верхних и нижних дыхательных путей определяется в первую очередь вероятностью этиологической роли того или иного микроорганизма в конкретной клинической ситуации. Такой подход требует от практического врача (а именно от него зависит адекватный выбор препарата) умения выявлять особенности каждого случая пневмонии (эпидемиологическую обстановку, фоновую патологию, факторы риска и др.) и ориентировки в антимикробном спектре назначаемого антибиотика. Однако в клинической практике при выборе ЦА, как, впрочем, и других антибиотиков, приходится наряду с ориентировочной этиологией бронхолегочной инфекции учитывать и другие факторы. Среди последних имеет значение фармакокинетика препарата, наличие разнообразных лекарственных форм, риск развития побочных эффектов, стоимость и др.
В настоящее время не окончательно определено место пероральных препаратов III поколения в клинической практике, так как их сравнительная клиническая и бактериологическая эффективность мало отличается от препаратов II поколения. Более того, как было сказано выше, преимущество цефалоспоринов III поколения состоит в их высокой активности в отношении b-лактамазопродуцирующих бактерий, наиболее часто вызывающих серьезные стационарные инфекции. Но поскольку в этом случае больные находятся в стационаре, то уже более обоснованно получают парентеральную терапию. В то же время ввиду сниженной активности в отношении грамположительных бактерий, часто являющихся причиной именно амбулаторной инфекции, назначение препаратов III поколения имеет меньше преимуществ перед препаратами II поколения.
Цель антибактериальной терапии состоит не только в достижении клинического эффекта, но и в полной эрадикации возбудителя, т. е. бактериологической эффективности. Это в основном определяется адекватным дозированием препарата для достижения необходимой концентрации в очаге инфекции. Высокая степень накопления препарата в тканях является необходимым требованием к лекарственному веществу.
ЦА первого поколения хуже проникают в ткани, что уменьшает степень бактериальной эрадикации.
Данные о биодоступности оральных ЦА следует иметь в виду при дифференцированном назначении их больным с сопутствующей патологией кишечника, связанной с нарушением всасывания, а также при одновременном приеме антисекреторных препаратов, антацидов, с учетом влияния пищи на всасывание ЦА.
Знание путей элиминации ЦА наряду с оценкой функционального состояния печени и почек (возраст, сопутствующая патология) также может определять выбор более адекватного для данной ситуации препарата. Выбирая ЦА для лечения тяжелых госпитальных пневмоний, например, у новорожденных и стариков или у больных с патологией почек, при наличии почечной недостаточности предпочтение следует отдать цефоперазону с учетом его преимущественно билиарной экскреции.
При дифференцированном выборе ЦА необходимо учитывать риск развития побочных эффектов. Наиболее типичны реакции гиперчувствительности (лихорадка, кожная сыпь), гематологические синдромы (цитопения, эозинофилия), нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея), печени (повышение активности трансаминаз), почек (повышение уровня креатинина), ЦНС (головная боль), флебиты при внутривенном введении. Поэтому анамнестические и клинико-лабораторные данные о наличии у больных какой-либо патологии должны влиять на выбор соответствующего препарата.
Флебиты часто возникают при введении цефалотина, цефотаксима, цефепима. Цефуроксим, цефоперазон, цефтибутен могут вызывать анемию (чаще гемолитическую), а при назначении цефалотина, цефамандола, цефотаксима, цефтазидима иногда выявляются фиксированные на эритроцитах антитела. Повышение активности печеночных ферментов возможно на фоне лечения цефоперазоном, цефтриаксоном, цефтазидимом, цефуроксимом. Уровень креатинина может повышаться при лечении цефалексином и цефподоксимом. Оральные цефалоспорины чаще всего вызывают нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея). При лечении парентеральными ЦА отмечено увеличение протромбинового времени, за исключением цефтазидима, не влияющего на синтез факторов протромбинового комплекса и показатели свертываемости крови. Возможны реакции гиперчувствительности (кожная сыпь, лихорадка, эозинофилия) на фоне применения почти всех ЦА III поколения.
Таким образом, дифференцированный выбор ЦА для лечения инфекций верхних и нижних дыхательных путей должен базироваться на учете и адекватной оценке многих факторов, включающих как особенности клинической ситуации, так и антимикробную активность и фармакокинетические характеристики назначаемого препарата.