можно ли давать антибиотики при ацетоне
Детская болезнь под названием «ацетон»
Врачи-педиатры в последние годы все чаще сталкиваются с жалобами мам на запах ацетона у детей. Нередко к запаху присоединяются и другая симптоматика – рвота и температура.
Что делать в таких случаях и не опасно ли подобное состояние?
Помощь ребенку при запахе ацетона изо рта
Сначала сделайте малышу сладкий теплый чай.
А для определения ацетона существуют специальные тест-полоски, которые продаются в обычной аптеке. Такую тест-систему лучше иметь всегда, если дома есть ребенок.
Следует прочесть инструкцию к системе и сделать тестирование. В зависимости от полученных результатов предпринимается комплекс мер.
Изучите достоверную информацию по ацетономическому синдрому. Именно так врачи называют это состояние.
Почему у детей бывает запах ацетона изо рта?
Внимание! Запах, напоминающий ацетон – это не заболевание и не сахарный диабет, как думают многие. Это признак того, что у ребенка истощены запасы гликогена. Гликоген необходим для производства энергии, его дефицит происходит при нарушенном обмене веществ и именно тогда, когда гликогена в организме малыша мало.
Мам больше всего пугает рвота у детей. Позывы на рвоту и потеря аппетита появляется из-за избытка кетоновых тел, которые:
1. Действуют непосредственно на рвотный центр в головном мозге.
2. Подавляют центр голода.
3. Оказывают раздражение на слизистые оболочки желудочно-кишечного тракта, так как проходят через кишечник. Из-за этого у ребенка может быть не просто тошнота и рвота, но и болеть живот.
Выводы. Ацетон у детей – это не патология (то есть болезнь), а специфическая реакция организма на дефицит глюкозы в крови. Ацетон появляется при расщеплении жиров в организме с образованием кетоновых тел в таком количестве, которое организму сложно вывести. Родители обязаны знать, как помочь малышу в таких случаях.
В случае если Вы обнаружили похожие симптомы, всё же лучше сразу записаться на приём к педиатру. по тел. (843) 222-52-38
Коэнзимное ацетилирование и уровень свободных жирных кислот крови у детей с ацетонемией и билиарной недостаточностью
Изучены активность коэнзимного ацетилирования и показатели уровня свободных жирных кислот в крови у детей при гастродудоденобилиарной патологии, влияние тиолсодержащих и энерготропных препаратов на активность СоА, разработана терапия для профилактики ацет
Are studied the activity of Coenzyme acetylation and indices of the level of free fatty acids into the blood in children with gastroduodenobiliar pathology, influence of thiol containing and energy-tropic preparations on the activity of SoA, is developed therapy for the preventive maintenance of acetonemic metabolic crises.
.jpg)
Ключевой механизм, обусловливающий развитие ацетонемии, связан с дефицитом фермента коэнзимного ацетилирования [3]. Процессы ацетилирования занимают центральное место в межклеточном обмене веществ и наиболее интенсивно протекают в печени. Путем ацетилирования осуществляется окислительное декарбоксилирование пировиноградной кислоты, синтез и распад жиров, синтез ацетилхолина, стероидов и др. При исключении из диеты пантотеновой кислоты происходит уменьшение содержания кофермента А (КоА) в тканях [4]. Активность КоА определяется также наличием в его структуре сульфгидрильных (SH) групп. Среди активаторов фермента КоА большое значение имеют соединения, содержащие SH-группы [1]. Среди тиоловых соединений в клинической практике наиболее известен Унитиол, который эффективно используется при тяжелых интоксикациях [5]. Расположение SH-групп в структуре Унитиола (2,3?димеркаптопропансульфата натрия) таково, что они могут активно вступать в метаболические процессы. По мнению А. Лабори [6], тиоловые соединения вызывают метаболическую реанимацию в связи с присутствием в их структуре SH-групп. Эффективны тиоловые группы в препарате Липоевая кислота (Липамид). Это позволило применить препараты, содержащие сульфгидрильные группы с целью активации КоА [6].
Цель исследования. Изучить активность коэнзимного ацетилирования и показатели уровня свободных жирных кислот (СЖК) в крови у детей с рецидивирующими приступами ацетонемических рвот при гастродуоденобилиарной патологии. Оценить влияние тиолсодержащих и энерготропных препаратов на активность КоА, разработать протекторную терапию для профилактики ацетонемических метаболических кризов.
Материал и методы. Под наблюдением находилось 65 пациентов в возрасте от 3 до 10 лет с заболеваниями органов пищеварения. В комплекс обследования включались оценка клинико-анамнестических данных, анализы клинического минимума, УЗИ органов брюшной полости, фиброгастродуоденоскопия с проведением хелпил-теста, гастроимпедансометрия, биохимические исследования крови: протеинограмма, сахар, холестерин (традиционными методами), уровень свободных жирных кислот (СЖК) — колорометрическим методом Duncombe [7]. Определение активности КоА проводилось по методу Л. Н. Буловской [4]. Качественным методом (тест-полоски) проводилось определение ацетона в моче.
Результаты. Основной жалобой у больных при поступлении в стационар были приступы тошноты, слабости, рвоты от 3 до 8 раз в сутки с последующим появлением запаха ацетона изо рта и ацетонурии. Рецидивы ацетонемических рвот у детей приводили к ухудшению у них трофического статуса и нарушению иммунологической резистентности организма. Возникала подверженность детей вирусным инфекциям, на фоне которых ацетонемия была их постоянным спутником, развивался причинно-следственный порочный круг.
В результате проведенного обследования у 22 детей был выявлен поверхностный антральный гастрит, у 18 детей — поверхностный распространенный гастрит и у 25 пациентов — поверхностный гастродуоденит с узелковой гиперплазией в антральном отделе желудка. Хелпил-тест у обследованных детей был отрицательным. Показатели гастроимпедансометрии подтвердили диагнозы хронического гастрита и хронического гастродуоденита (ХГД) у детей. У 30 пациентов кислотообразующая функция желудка была повышенной, у 35 больных — резко повышенной. У всех обследованных детей по данным УЗИ была выявлена сопутствующая дискинезия желчевыводящих путей (ДЖВП), гипертонический тип, из них у 35 детей (53,8%) были осадочные образования в желчи (явления холестаза), у 30 детей — желчь не имела осадочных образований.
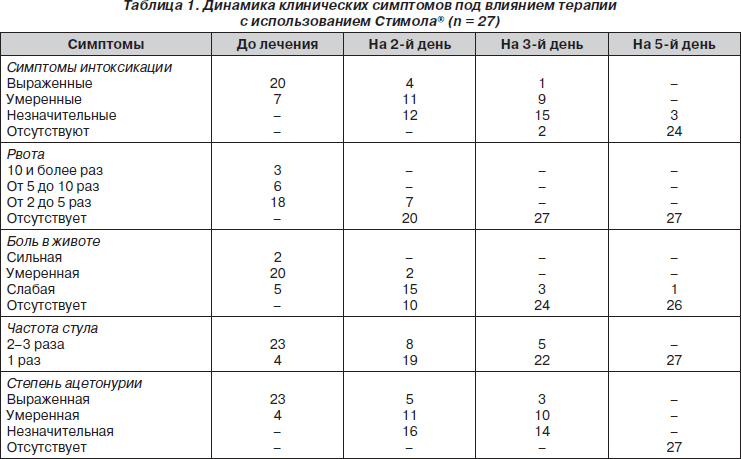
Биохимические исследования крови выявили разной степени выраженности диспротеинемию, дислипидемию и тенденцию к гипогликемии. Активность КоА и уровень СЖК в крови у обследованных детей на фоне ацетонемии представлены в табл. 1. Ацетонурия у всех обследованных детей была резко выраженной (ацетон мочи был на ++ или +++).
Активность КоА у детей до начала лечения на фоне ацетонемии была резко сниженной, наиболее значимо у пациентов с сопутствующей ДЖВП с осадочными образованиями в желчи, составив только 25% от возрастного норматива (р2-3 0,05), в то время как этот же показатель у больных с проявлениями холестаза увеличивался в 3 раза по сравнению с исходным значением, однако средняя величина активности КоА достоверно отличалась от таковой в контроле (28,12 ± 1,02% и 37,0 ± 0,27%, р2-3 0,05). У детей с ДЖВП при выраженных проявлениях холестаза средняя величина содержания СЖК в крови снизилась по сравнению с исходным значением в 2,6 раза и составила 310,0 ± 17,5 при норме 187,2 ± 25,4 мкмоль/л, однако данный показатель еще достоверно отличался от возрастного норматива (р2-3 12 /л; гематокрит — 38 об%; тромбоциты — 330 × 10 9 /л; лейкоциты — 6,5 × 10 9 /л; палочкоядерные — 1%; моноциты — 3%; СОЭ — 8 мм/час.
Анализ мочи — цвет ярко-желтый, относительная плотность — 1018; белок — нет, сахар — нет, лейкоциты — 2–3 в п/зр., соли оксалатов +, ацетон ++++.
Биохимический анализ крови: аланинаминотрансфераза — 13,1 ед.; аспартатаминотрансфераза — 18,2 ед.; сахар крови — 3,5 ммоль/л; мочевина — 6,2 ммоль/л; билирубин общий 16,7 мкмоль/л; амилаза — 47,2 ед., СЖК — 680,3 мкмоль/л; мочевая кислота — 600 мкмоль/л; активность КоА — 9,8% (при средней норме 37%); калий — 3,9 ммоль/л; натрий 134 ммоль/л; хлор — 106 ммоль/л; рН — 7,4.
Реакции непрямой гемагглютинации крови с кишечными и иерсиниозными диагностикумами — отрицательная.
Бактериологические посевы кала на дизентерийную и тифо-паратифозную флору отрицательные. Иммуноферментный анализ кала на ротавирусы — положительный. Копрограмма: консистенция жидкая, крахмал внеклеточный +, крахмал внутриклеточный ++; лейкоциты 10–15 в п/зр.; слизь +++.
Фиброгастродуоденоскоспия: распространенный поверхностный гастрит, поверхностный дуоденит, эрозивный эзофагит. Helicobacter pylori (-).
УЗИ органов брюшной полости: обнаружена деформация желчного пузыря, перетяжка в области шейки, осадочные образования в желчи.
В результате проведенного обследования установлен диагноз острого гастроэнтерита, ротавирусной этиологии. Сопутствующие заболевания: хронический гастродуоденит, поверхностный тип, в фазе обострения. Эрозивный эзофагит. Нутритивная недостаточность 1-й ст. Осложнение: синдром ацетонемии.
Проведенное лечение. Дробное питье минеральной воды Боржоми, чая. В связи с повторными рвотами после питья — инфузия внутривенно 10% раствора глюкозы и раствора Рингера в соотношении 1:1 в объеме 400 мл/сутки в течение первых 2 дней лечения, витамин В6 внутривенно 50 мг, витамин С 200 мг. Витамин В12 внутримышечно по 500 мкг № 3, внутрь Липоевая кислота по 25 мг 2 раза в сутки и пантотенат кальция 100 мг/сутки. После ликвидации рвот назначался Элькар по 28 капель 2 раза в сутки, Маалокс и Гевискон внутрь.
В результате проведенного лечения состояние ребенка улучшилось, температура тела нормализовалась к концу первого дня лечения, рвоты исчезли на вторые сутки терапии, возобновился аппетит и оформился стул на 3-й день госпитализации.
Ребенок выписан в удовлетворительном состоянии с рекомендацией соблюдения диеты стола 1, исключением потребления тугоплавких жиров, шоколада, субпродуктов, «белого» мяса, продолжения приема антацидных и желчегонных препаратов. Для профилактики ацетонемических состояний назначен протекторный комплекс, состоящий из пантотената кальция (100 мг/сутки), Липоевой кислоты (25 мг/сутки), Элькара (20 капель 2 раза/сутки), витамин В6 и В1 (возрастные дозы). Курс лечения в течение 1 месяца (проводить 3 цикла в год). При дальнейшем наблюдении за пациенткой ацетонемические состояния не возобновлялись.
Выводы
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
ГБОУ ВПО СЗГМУ им. И. И. Мечникова Минздравсоцразвития России, Санкт-Петербург
ЭФФЕКТИВНОСТЬ МЕТАБОЛИЧЕСКОЙ КОРРЕКЦИИ АЦЕТОНЕМИЧЕСКОГО СИНДРОМА У ДЕТЕЙ
ЭФФЕКТИВНОСТЬ МЕТАБОЛИЧЕСКОЙ КОРРЕКЦИИ АЦЕТОНЕМИЧЕСКОГО СИНДРОМА У ДЕТЕЙ
Определение степени тяжести ацетонемического криза
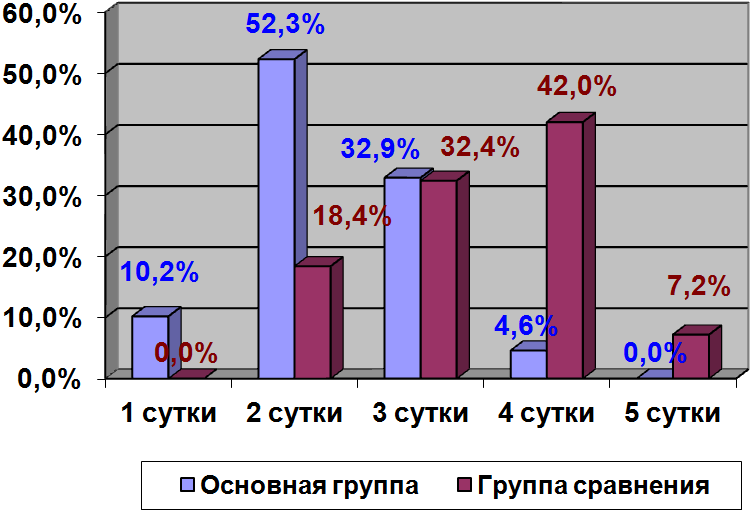
Результаты исследований и их обсуждение Комплексная медикаментозная терапия с включением Стимола ® на фоне режимных и диетических регламентаций позволила добиться положительной динамики клинико-лабораторных данных и быстрого купирования субъективных признаков болезни у всех пациентов основной группы уже в первые дни лечения. Проведенное исследование показало, что снижение и нормализация показателей лактата в течение первых 36 часов наблюдались у 76,3 % пациентов основной группы и 35,8 % группы сравнения. У остальных пациентов основной группы показатели лактата нормализовались через 48 часов, а у детей группы сравнения – через 72 часа. Существенным диагностическим критерием в оценке эффективности комплексной терапии является динамика купирования ацетонурии (диаграмма 1).
Диаграмма 1. Динамика купирования ацетонурии в процессе комплексного лечения (в %)
Частота эпизодов обострений АС у детей в течение года
Журнал «Здоровье ребенка» 3 (30) 2011
Вернуться к номеру
Новые подходы к лечению детей с ацетонемическим синдромом
Авторы: Дука Е.Д., Ярошевская Т.В., Недава О.А., Сапа Н.Б. Днепропетровская государственная медицинская академия Детская городская клиническая больница № 2, г. Днепропетровск
Версия для печати
В статье изложены результаты собственного опыта проведения метаболической коррекции у детей с ацетонемическим синдромом. Показана эффективность препарата Стимол®. На основании результатов оценки клинической эффективности даны рекомендации по использованию препарата Стимол® в комплексном лечении детей с ацетонемическим синдромом.
Ацетонемический синдром, лечение, дети, Стимол®.
В детском возрасте особого внимания требуют функциональные расстройства органов пищеварения, связанные с нарушением нейроэндокринной регуляции, как возможная основа для формирования органической патологии в дальнейшем. К таким заболеваниям можно отнести ацетонемический синдром, широко обсуждаемый в последние годы в литературе. В зарубежной литературе, а также в МКБ-10 данный синдром как отдельная нозологическая единица не выделяется, но в XVIII разделе МКБ-10 под рубрикой R11 представлен синдром циклической рвоты (CVS). Патогенетически и клинически эти два синдрома весьма близки, что, по-видимому, в последующем будет способствовать их конвергенции [3, 5, 6].
Под ацетонемическим синдромом понимают совокупность симптомов, обусловленных повышенным содержанием в крови продуктов неполного окисления жирных кислот, образующихся при распаде кетогенных аминокислот: ацетона, ацетоуксусной кислоты и g-оксимасляной кислоты [2, 3]. Различают первичный и вторичный ацетонемический синдромы. У детей целый ряд заболеваний сопровождается гиперкетонемией. К ним, в частности, относятся сахарный диабет, ренальная глюкозурия, гликогенозы, тиреотоксикоз, инфекционный токсикоз, токсические поражения печени, гиперинсулинизм, черепно-мозговые травмы, болезнь Иценко — Кушинга, лейкемия, гемолитическая анемия. Клиническая картина ацетонемического синдрома в таких случаях определяется основным заболеванием, а кетонемию и проявления типичной или атипичной подагры следует рассматривать как вторичный ацетонемический синдром.
Первичный ацетонемический синдром у детей считается манифестной формой мочекислого диатеза или нервно-артритической аномалии конституции (НААК) и относится к дисметаболическим генетически детерминированным патологическим состояниям. Заболевание характеризуется перманентной гиперурикемией, повышенной возбудимостью нервной системы и периодическими метаболическими кризами с гипогликемическим кетоацидозом, гиперкетонемией, кетонурией, дисэлектролитемией. В генезе заболевания определенную роль играет ферментопатия, результатом которой является недостаточная утилизация углеводов и жиров из пищи. Первичный ацетонемический синдром встречается у 4–6 % детей в популяции и у 50 % детей с НААК, обычно в возрасте от 1 года до 12 лет. Очень часто (почти в 90 % случаев) в структуре кризов наблюдается многократная рвота, которая определяется как ацетонемическая [2–4].
Дети с НААК характеризуются следующими особенностями:
— повышенной возбудимостью и быстрой истощаемостью нервной системы на всех уровнях рецепции с наличием доминантного очага застойного возбуждения в гипоталамо-диэнцефальной области;
— недостаточностью ферментов печени (глюкозо-6-фосфатазы, гипоксантин-гуанин-фосфорибозилпирофосфатсинтетазы);
— низкой ацетилирующей способностью ацетилкоэнзима А вследствие дефицита щавелевой кислоты;
— нарушением механизма повторного использования мочевой и молочной кислот;
— нарушением жирового и углеводного обмена;
— нарушением эндокринной регуляции метаболизма.
Согласно классическим представлениям, такие дети отличаются повышенной возбудимостью, эмоциональной лабильностью, нарушением сна. К концу первого года жизни они обычно заметно отстают в массе тела от сверстников. Нервно-психическое развитие, напротив, опережает возрастные нормы. Начиная с 2–3-летнего возраста отмечаются эквиваленты подагрических приступов и кризов в виде преходящих ночных болей в суставах, абдоминальных болей спастического характера, дискинезий желчевыводящих путей и желудка, мигрени, ацетонемических кризов. Одним из типичных проявлений НААК является салурия с преимущественной уратурией. Ацетонемические кризы у большинства детей прекращаются после 10–12 лет. Однако сохраняется высокая вероятность развития таких патологических состояний, как подагрические кризы, дисметаболическая нефропатия, холепатия, вегетососудистая дистония по гипертоническому типу, артериальная гипертензия [2].
Как во время ацетонемического криза, так и при приступе циклической рвоты наблюдается многократная неукротимая рвота. Патогенез этих состояний во многом сходен.
Как правило, при синдроме циклической рвоты отмечаются тошнота, рвота с примесью желчи, боль в животе, головная боль, неприятные ощущения во время движения, повышенная чувствительность к свету и шуму, однако это характерно не для всех больных. Кроме того, у некоторых больных имеются лихорадка, бледность, повышенная потливость, диарея, дегидратация, гиперсаливация, повышенное артериальное давление [5, 6].
В настоящее время синдром циклической рвоты рассматривается как полиэтиологическое заболевание, в основе которого лежат нарушения гипоталамо-гипофизарно-надпочечниковой системы (повышение секреции кортикотропин-рилизинг-фактора) и вегетативная дисфункция (симпатикотония). Многочисленные исследования показали, что инфекционные, психологические, физические стрессы могут вызывать приступы рвоты. Перед началом рвоты наблюдается значительное увеличение уровня АКТГ и кортикотропина.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [5, 6, 8]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел — аммиака и бета-изомасляной кислоты [2, 5]. Данные представления патогенетически сближают синдром циклической рвоты и ацетонемический синдром, а также объясняют необходимость и возможные пути метаболической коррекции.
За рвотный акт отвечают две функционально различные структуры продолговатого мозга — рвотный центр в латеральной ретикулярной формации и хеморецепторная триггерная зона в ромбовидной ямке на дне четвертого желудочка. Поэтому механизмов тошноты и рвоты два. Первый связан с афферентной импульсацией от органов пищеварения непосредственно рвотного центра. Второй обусловлен стимуляцией триггерной зоны такими медиаторами, как серотонин, ангиотензин ІІ, вазоактивный интестинальный полипептид, дофамин, антидиуретический гормон и др., а также рядом лекарственных препаратов, эндотоксинами грамположительных бактерий.
Через вегетативные гипоталамические центры под воздействием стресса происходит активация жиромобилизующих гормонов (соматотропин, липотропин), что приводит к избыточному липолизу и кетогенезу, при этом образуется большое количество кетоновых тел.
Обоснование диагноза синдрома циклической ацетонемической рвоты требует тщательного изучения анамнеза, данных физикального и лабораторного исследования, чтобы исключить другие болезни, которые могут вызвать рвоту, сходную с CVS.
Лечение
Программы купирования ацетонемического криза хорошо известны. При начальных симптомах целесообразно очистить и промыть кишечник 1–2% раствором гидрокарбоната натрия и поить ребенка каждые 10–15 минут сладким чаем с лимоном, негазированной щелочной минеральной водой (лужанская, боржоми и др.), 1–2% раствором гидрокарбоната натрия, комбинированными растворами для оральной регидратации. Пища должна содержать легко усваиваемые углеводы и минимальное количество жира (жидкая манная или овсяная каша, картофельное пюре, молоко, печеные яблоки). Медикаментозная терапия включает спазмолитики, энтеросорбенты. В связи с задержкой стула применение диосмектита нецелесообразно.
В случае развития ацетонемического криза, сопровождающегося многократной или неукротимой рвотой, лечение направлено на коррекцию ацидоза, кетоза, дегидратации и дисэлектролитемии. При нарастающем эксикозе показана инфузионная терапия. В качестве инфузионных растворов используются 5–10% раствор глюкозы с инсулином и кристаллоидные натрийсодержащие растворы (0,9% раствор натрия хлорида, раствор Рингера) в соотношении 1 : 1 или 2 : 1 с учетом показателей водно-электролитного обмена. Общий объем вводимой жидкости составляет 50–60 мл/кг в сутки. Если ребенок пьет охотно, парентеральное введение инфузионных растворов может быть полностью или частично заменено оральной регидратацией, которая проводится комбинированными препаратами.
Лечение ацетонемического синдрома в межприступный период направлено на профилактику рецидивов ацетонемических кризов и проводится курсами, не менее 2 раз в год, как правило, весной и осенью. Могут назначаться гепатопротекторы, при частых и тяжело протекающих ацетонемических кризах с целью профилактики назначают производные урсодезоксихолевой кислоты.
Режимные ограничения у детей с НААК должны соблюдаться постоянно: достаточное пребывание на свежем воздухе, регулярные, строго дозированные физические нагрузки, водные процедуры (плавание, контрастный душ, обливание), достаточный по продолжительности сон (не менее 8 часов). Следует избегать инсоляции. Целесообразно сократить время просмотра телевизора и работы с компьютером. В диете должны преобладать молочнокислые продукты, каши, свежие овощи, фрукты, отварное мясо нежирных сортов.
Необходимо ограничить употребление продуктов, богатых пуринами и кетогенными аминокислотами. Из рациона исключаются мясо молодых животных, жирные сорта мяса, субпродукты, копчености, концентрированные бульоны. Противопоказаны щавель, цветная капуста, томаты, цитрусовые, напитки, содержащие кофеин [3, 4].
Несмотря на успешное применение патогенетически обоснованных дифференцированных схем в лечении ацетонемического синдрома у детей, эта проблема в настоящее время не теряет актуальности. Наряду с регидратационной терапией важным звеном в лечении синдрома является коррекция метаболических нарушений. С нашей точки зрения, с этой целью оправданно использование препарата Стимол® (Biocodex, Франция).
В последнее время накоплен положительный клинический опыт применения Стимола® для лечения первичного ацетонемического синдрома как в период приступа, так и в межприступный период [1–3].
Целью настоящего исследования стало изучение эффективности Стимола® в комплексной терапии ацетонемического синдрома у детей в кризовый период.
Материалы и методы
В состав препарата метаболического действия Стимол® входят две аминокислоты — малат и цитруллин, которые активизируют механизм образования энергии на клеточном уровне. В норме они всегда присутствуют в организме человека и являются катализаторами жизненно важных метаболических процессов. Малат — яблочная кислота, которая стимулирует цикл Кребса, принимает участие в процессе глюконеогенеза, уменьшает уровень лактата в крови и тканях, предупреждает лактат-ацидоз, способствует синтезу АТФ и является основным поставщиком энергии для метаболических процессов. Цитруллин — одна из аминокислот, которая входит в цикл мочевины. Цитруллин активирует образование и выведение аммиачных соединений из организма. Таким образом, Стимол® обеспечивает утилизацию лактата, аммиака и способствует образованию энергии, переводя клетку на другой энергетический уровень.
Исследования с целью оценки эффективности препарата Стимол® при первичном ацетонемическом синдроме у детей проводили на базе гастроэнтерологического отделения детской клинической больницы № 2 г. Днепропетровска. Нами были обследованы 37 детей с синдромом ацетонемической рвоты: 18 девочек и 19 мальчиков в возрасте от 3 до 12 лет (средний возраст 5,5 года), 10 из которых составили группу сравнения.
В основной группе на фоне базисной терапии назначали Стимол®, по 1/2 пакетика детям от 3 до 6 лет и по 1 пакетику детям старше 6 лет, 3 раза в день, растворяя содержимое в 100 мл теплой воды. Вводили препарат с первых часов после госпитализации дробно, маленькими порциями во избежание провоцирования рвотного рефлекса. Дети из группы сравнения получали только базисную терапию — диету, парентеральную и пероральную регидратацию, дезинтоксикационную терапию, энтеросорбцию, по показаниям — антибактериальные средства, спазмолитики, ферментные препараты.
Динамику клинических проявлений у детей в обеих группах оценивали по специально разработанной балльной шкале в зависимости от степени выраженности основных симптомов. Оценивали следующие показатели: признаки интоксикации, частоту рвоты, выраженность болевого абдоминального синдрома, диспептических проявлений, а также степень кетонурии в баллах от 0 до 4. Выраженность клинических проявлений по сумме баллов была прослежена в течение первых 7 дней лечения. Динамика выраженности кетонурии под влиянием назначенной терапии на протяжении первых суток прослеживалась каждые три часа. С этой целью использовали тест-полоски для быстрого выявления кетонов в моче. Принцип определения основан на реакции ацетоуксусной кислоты с нитропруссидом натрия, при этом цвет полоски изменяется с бежевого на красно-фиолетовый. Оценка результатов проводилась визуально путем сравнения реагентной полоски с цветовой шкалой, нанесенной на контейнер. Степень ацетонурии определяли от + до ++++ (или в баллах от 1 до 4).
Результаты и их обсуждение
Установлено, что чаще всего приступы ацетонемической рвоты провоцировались нарушением диеты (16,2 %), инфекционным заболеванием (29,7 %), обострением хронической патологии желудочно-кишечного тракта (21,6 %), психологическим, чаще позитивным, стрессом (32,4 %). Фоновыми патологиями были функциональная диспепсия (8,1 %), синдром раздраженного кишечника (5,4 %), дискинезия желчевыводящих путей (83,8 %), хронический холецистохолангит (5,4 %), панкреатопатии (29,6 %), пищевая аллергия (18,9 %), вегетативные дисфункции (54 %). В большинстве случаев выявлена отягощенность перинатального анамнеза (патология течения беременности и родов, травматическое и гипоксическое поражение ЦНС). Семейный анамнез был отягощен наличием хронических заболеваний ЖКТ, желчнокаменной и мочекаменной болезнью, гипертонической болезнью у близких родственников.
При поступлении в стационар общее состояние у всех больных было тяжелым за счет дегидратации и симптомов интоксикации.
В клинике преобладали боли в животе, анорексия, вялость, тошнота, повторная рвота, повышение температуры тела, тахикардия. У 100 % детей реакция мочи на ацетон была позитивной. Уратурия была выявлена у 29,6 % детей, оксалурия у 21,6 %, уровень диастазы мочи и амилазы крови у обследованных детей оставался нормальным. Гипогликемия выявлена у 3 больных, гипохромная анемия — у 16,2 %, лейкоцитоз и нейтрофилез — у 13,5 %, лимфоцитоз — у 40,5 %. Уровни мочевины, креатинина, холестерина у всех детей были в пределах нормы. По данным копрограммы у 100 % детей выявлена функциональная недостаточность поджелудочной железы (стеаторея, амилорея от ++ до +++), по данным ультразвукового исследования — увеличение, зернистость, повышение эхогенности поджелудочной железы у 29,6 %, обращал на себя внимание выраженный метеоризм кишечника у 48,6 % пациентов.
С учетом роли нарушений энергетического обмена в развитии ацетонемического синдрома в комплексы терапии был обоснованно включен цитруллина малат. Это обусловлено его дезинтоксикационными (улучшение работы цитохромоксидазной системы, инактивация аммония, лактата), антигипоксическими (стимуляция работы цикла Кребса, переключение утилизации глюкозы на аэробный путь), антиацидотическими (ускорение утилизации лактата) свойствами.
Под влиянием терапии происходило быстрое улучшение состояния детей за счет регресса основных клинических проявлений (табл. 1). Следует подчеркнуть, что с самого начала терапии скорость их редукции оказалась достоверно выше в основной группе.
Оценка состояния ребенка в баллах при поступлении в основной и в контрольной группе была приблизительно одинаковой и составила в среднем 9,18. Однако уже на второй день терапии с использованием Стимола® выраженность клинических проявлений составляла 5,64 балла, тогда как в контрольной группе — 6,08. На третий день в основной группе — 4,09 балла, в группе сравнения — 4,86 балла (P Список литературы
1. Бережной В.В., Курило Л.В. Метаболическая коррекция у детей с ацетонемическим синдромом: Информационное письмо № 12. Выпуск 2 по проблеме «Педиатрия». — 2008.
2. Бережной В.В., Курило Л.В., Марушко Т.В., Капичена М.А. Эффективность метаболической коррекции ацетонемического синдрома у детей // Современная педиатрия. — 2009. — № 5(27). — С. 89-92.
3. Волосовец А.П., Кривопустов С.П., Кожина А.Н., Щербинская Е.Н. Ацетонемический синдром у детей: современный взгляд на проблему // Здоровье ребенка. — 2009. — № 6(21). — С. 76-81.
4. Казак С., Бекетова Г. Діагностика та дієтотерапія ацетонемічного синдрому у дітей // Ліки України. — 2005. — № 2. — С. 83-86.
5. Майданник В.Г. Синдром циклічної блювоти у дітей // Педіатрія, акушерство і гінекологія. — 2009. — № 3. — С. 5-13.
6. Сапа Ю.С. Синдром циклической рвоты у детей: «terra incognita» или Золушка отечественной педиатрии // Medicus amicus. — 2006. — № 2.