можно ли давать детям ежевик гребенчатый
Советы онколога: Простые «Да» и «Нет», которые продлят жизнь
Онкологические заболевания уже давно стали чумой нынешнего столетия. Более 200 видов раковых заболеваний убивает в год более 8 миллионов человек. При этом, Всемирная организация здравоохранения прогнозирует рост случаев онкологических заболеваний в ближайшие 20 лет на 70%. Страшно…
Простые советы, которые сберегут здоровье
На днях я получила от нашего семейного доктора список простых рекомендаций практикующих онкологов столицы для профилактики раковых заболеваний, чем и хочу поделиться:
Скажи «НЕТ!»:
1. Рафинированному маслу
2. Молоку животного происхождения, кроме домашнего
4. Газировке (Это 32 куска сахара на литр!)
5. Микроволновой печи
6. Маммографии до родов кроме эхограммы.
7. Слишком обтягивающему белью (бюстгалтеру)
9. Размороженной еде
10. Воде из холодильника в пластмассовых бутылках
11. Противозачаточным таблеткам.
12. Дезодорантам (опасны особенно используемые после бритья).
Скажи «ДА!»:
2. Меду в умеренных количествах вместо сахара
3. Растительным белкам (бобы вместо мяса)
4. Двум стаканам воды на пустой желудок перед тем, как чистить зубы.
5. Теплой еде, не горячей
6. Противораковому соку №1: алоэ вера + имбирь + петрушка + сельдерей + промалин (середина ананаса), смешать и пить на пустой желудок.
7. Противораковому соку №2: сметанное яблоко/гуанабана (без косточек) + промалин (середина ананаса)
8. Сырой или вареной морковь или свежие выжатому морковному соку, каждый день.
И еще несколько рекомендаций на заметку:
1. Не пейте чай из пластиковых стаканчиков (чашек). Не ешьте ничего горячего из бумажного или полиэтиленового пакета (например, жареный картофель). Не разогревайте в микроволновке еду в пластмассовой посуде.
2. Когда пластмасса подвергается нагреву, выделяются химические соединения, которые могут вызвать 52 типа раковых заболеваний.
3. Избегайте пить Кока-колу на ананасе или после того, как Вы ели ананас как десерт. Не смешивайте сок ананаса с Кокой.
4. Эта смесь смертельна! Люди умирают от этого, и они по ошибке полагают, что были отравлены…. Они были жертвами своего незнания этого фатального коктейля!
5. Отвечайте на звонки, поднося телефон к левому уху. Когда батарея Вашего телефона практически села, не берите трубку, так как при этом излучение радиации в 1000 раз более сильное, чем при заряженном аккумуляторе.
6. Не запивайте лекарства холодной водой
7. Не ешьте тяжелую пищу после 17.00
8. Пейте больше воды утром, меньше к вечеру
9. Не принимайте горизонтальное положение сразу после еды и употребления лекарственных препаратов
Данная статья носит информационный характер, более подробно о методах профилактики рака Вам может рассказать Врач-онколог Общества.
ООО «Инновационные технологии» благодарит Вас за то,
что вы нашли время и прочли эту информацию.
Что нельзя делать при выпадении волос
10 “нельзя” или что не рекомендуется делать при выпадении волос
Волосы у человека давно уже утратили свою биологическую целесообразность – они не защищают нас от холода и ветра, других негативных факторов. Единственная функция, которую продолжает осуществлять волосяной покров, – это эстетическая.
Волосы представляют и для мужчин, и для женщин, огромную психологическую ценность, а их потеря становится для большинства тяжелой эмоциональной трагедией. Необходимо хорошо представлять, что запрещено делать при выпадении волос, ведь неправильное поведение в этот момент может повлиять на течение процесса потери волос и привести к его усугублению.
Какие ошибки мы совершаем, столкнувшись с выпадением волос
При выпадении волос нельзя паниковать
Всем известна тесная взаимосвязь процесса выпадения волос и состояния психо-эмоционального фона. Ведь стресс является фактором-причиной выпадения, а может и затягивать выпадение, вызванное другими факторами. Перспектива грядущего облысения – одна из основных причин, способствующих появлению невроза, особенно у женщин, от природы обладающих густым волосами. Чем дольше протекает выпадение, тем больше становится страх потерять «последние» волосы и возрастает акцентуация на факте выпадения. Необходимо понять, что сильные и внезапные формы выпадения волос чаще всего являются наиболее благоприятными, чаще всего они имеют четкую связь с перенесенной температурой, заболеванием, лекарством и т.д., и в большинстве случаев проходят даже сами по себе.
Нельзя мыть голову редко
Мытье головы является важной мерой ухода за волосами, особенно в период активного выпадения волос. Ограничение кратности мытья, особенно боязнь мытья головы, нежелательна не только с психологической точки зрения, но и с точки зрения здоровья. Сальный секрет, накапливающийся на поверхности головы при редком мытье, может являться причиной воспаления кожи и усугубления выпадения волос. Наоборот, трихологи рекомендуют в периоды активного выпадения усиливать очищение кожи – использовать активные медицинские шампуни, регулирующие сальность, и пилинги, эксфолианты.
Нельзя ограничивать расчесывание волос, «накапливать» выпадающие волосы
Стадия выпадения волоса длится 3 месяца – это период от прекращения роста волоса до того момента, как волос покидает кожу головы. Если волосы не вычесывать вовремя, то мертвый волос механически будет препятствовать росту «нового» волоса, растущего вместо него.
Нельзя находиться на солнце без головного убора
Доказана роль негативного влияния ультрафиолета на потерю волос. Чем интенсивнее выпадение, чем более редкими волосы становятся, тем больше будет прогрессия процесса потери волос.
Нельзя собирать и подсчитывать выпавшие волосы
По статистике трихологов, собирание и подсчет волос, которые покинули голову, обладает только негативным эффектом на течение выпадения волос. Собирание волос способствует акцентуации женщин на процессе потери волос, невротизирует, а ни в коем случае не позволяет понять, насколько выпадение превышает суточную норму.
Нельзя втирать масла в кожу головы
Кожа головы относится к зоне с очень высокой секрецией кожного сала. Дополнительное нанесение жирных средств, особенно масел, которые обладают комедоногенным действием, может способствовать появлению воспаления, перхоти и болезненности кожи и усугубить выпадения.
Нельзя сидеть на гипокалорийной и безбелковой диете
Клетки волосяного фолликула относятся к одним из наиболее интенсивно делящихся клеток человеческого организма, именно поэтому им требуется большое количество энергии для нормального метаболизма. Считается, что калорийность пищевого рациона менее 1200 ккал может приводить к выпадению волос. Что касается белка, это основной структурный элемент стержня волоса (белок кератин), поэтому в пищевом рационе обязательно должны присутствовать все незаменимые аминокислоты.
Нельзя отменять оральные контрацептивы
Многие из существующих оральных контрацептивов обладают положительным влиянием на рост волос, поскольку содержать женские гормоны эстрогены, а в ряде случаев снижают и мужские. Отменять «подпитывающие» фолликул препараты не целесообразно в момент выпадения, когда клетки волоса и так слишком чувствительны ко всем неблагоприятным факторам.
Нельзя лечить волосы иммуностимуляторами и противогельминтнами препаратами
По старинке, часть врачей связывают выпадение волос со сниженным иммунитетом или глистной инвазией, назначая соответствующие препараты для «лечения» потери волос. На самом деле большинство иммуностимуляторов и антигельминтных лекарств, наоборот, являются «виновниками» выпадения.
Нельзя самостоятельно начинать и отменять препараты с миноксидилом
Миноксидил – единственный препарат для наружного применения, который имеет высокую степень эффективности при поредении волос. В России он находится в свободной продаже и часто начинает применяться самостоятельно, по рекомендации фармацевта или консультанта в интернете. Тем не менее, миноксидил – препарат для постоянного применения, который обладает «синдромом отмены», может вызывать нежелательные явления и дает усиления в начале применения. Именно поэтому при острых, доброкачественных формах выпадения, при диффузном выпадении он может только навредить.
Не стоит отчаиваться, столкнувшись с выпадением волос. Чаще всего, это временное явление, которое не принесет непоправимых последствий. Помните, что если выпадение волос продолжается до 3 месяцев, волосы покидают голову со всей поверхности, – это острое выпадение, которое при правильном уходе пройдет даже само по себе.
Значение коррекции питания в терапии расстройств аутистического спектра у детей

Статья содержит обзор современных литературных данных, посвященных использованию безглютеновой, безказеиновой и кетогенной диет в комплексном лечении детей с расстройствами аутистического спектра. Рассмотрены вопросы лабораторной диагностики непереносимо
The article contains a review of current literature data on the use of gluten-free, casein-free and ketogenic diets in the complex treatment of children with autism spectrum disorders. The questions of laboratory diagnostics of intolerance of food components are considered, examples of clinical efficiency of correction of food, and also the researches reflecting lack of dynamics in sticking to the diets are given.
Расстройства аутистического спектра (РАС) можно отнести к числу тех патологий, распространенность которых во всем мире в последние годы возрастает в геометрической прогрессии. Согласно последним статистическим сведениям аутичные черты отмечаются у каждого 60-го ребенка на планете. По некоторым данным РАС коснулись 1–2% населения всего мира [1–2]. Общая распространенность аутизма в США в группе детей 4-летнего возраста достигала в 2010 г. 13,4 на 1000, возросла до 15,3 к 2012 г. и еще через 2 года (2014 г.) составила 17,0 на 1000 детского населения. Учеными замечена тенденция увеличения числа детей с аутизмом в этой возрастной группе, объясняемая тем, что диагноз РАС впервые устанавливается чаще именно в 4-летнем возрасте. Таким образом, рост количества пациентов отмечается из-за случаев впервые официально диагностированных расстройств. Авторы отмечают значимость ранней диагностики РАС для организации своевременной терапевтической помощи, психолого-педагогической коррекции, что, безусловно, будет положительно влиять на результаты для детей с аутизмом [3]. Аутизм называют «неврологической чумой XXI века», в связи с чем всестороннее изучение вопросов ранней диагностики, всестороннего лечения и комплексной реабилитации является крайне актуальным [2].
В настоящее время продолжаются исследования, посвященные патогенетическим аспектам развития РАС, изучаются топографические особенности головного мозга. Новый виток развития получили в последние годы исследования механизмов влияния желудочно-кишечного тракта на возникновение расстройств и обоснование использования диет в комплексном лечении [4–5].
В объективе научных исследований в основном находятся глютен, казеин и углеводы пищи как основные компоненты питания, элиминация из пищи которых может способствовать улучшению течения заболевания. Наиболее изученной и широко распространенной среди пациентов с РАС является безглютеновая диета (БГД). При проведении собственных исследований установлена высокая частота встречаемости непереносимости глютена у детей с РАС. У 33 детей с аутизмом в возрасте от 2,5 до 15 лет определены генетические и серологические маркеры непереносимости глютена. При этом у 41,9% пациентов установлено наличие генетической предрасположенности к целиакии, а у 13,8% определяется чувствительность к глютену. Следует отметить, что необходимо использовать индивидуальный подход при назначении и оценке эффективности БГД [5–6].
J. W. Blackett с соавт. изучили структуру заболеваемости пациентов, проходящих лечение в медицинском центре Колумбийского университета в 2011–2016 гг., придерживающихся диетотерапии. Авторами установлено, что из 769 стационарных больных 63,6% не имели целиакии. Остальные пациенты имели такую патологию, как воспалительные заболевания (OR 1,56; 95% ДИ 1,02–2,41) и синдром раздраженного кишечника (OR 6,16; 95% ДИ 2,11–10,23), заболевания щитовидной железы (OR 2,73; 95% ДИ 1,22–6,10 — для гипертиреоза и OR 2,06; 95% ДИ 1,39–3,06 — для гипотиреоза), системная красная волчанка (OR 2,87; 95% ДИ 1,13–7,29) и РАС (OR 23,42; 95% ДИ 5,29–103,73), что позволяет предположить, что пациенты с данными заболеваниями используют диетотерапию как дополнительный терапевтический фактор, несмотря на необоснованную доказательную базу [7]. Существует исследование, подтверждающее использование БГД на момент опроса или в прошлом 31,5% детьми с РАС в возрасте 30–68 месяцев. Родители всех пациентов отмечают клинический эффект от использования как со стороны желудочно-кишечного тракта, так и психоневрологического статуса. При этом из всех пациентов, когда-либо использовавших БГД, лишь в половине (50,7%) случаев диетотерапия была назначена врачом [8]. Ряд исследований подтверждают повышение титров серологических маркеров непереносимости глютена (антител к глиадину и деамидированным пептидам глиадина) при проведении лабораторной диагностики у детей с РАС [6, 8]. H. D. Pusponegoro с соавт. [9] в своем исследовании демонстрируют противоположные данные. Ученые провели рандомизированное контролируемое двойное слепое исследование с участием 74 пациентов детского возраста с аутизмом, которым было предложено соблюдать БГД в течение недели. После подведения итогов установлено отсутствие клинического эффекта. F. Navarro с соавт. предложили детям с РАС 4-недельный курс БГД, при этом они также не отмечали наличие клинического эффекта [10].
Литературные данные об использовании безказеиновой диеты (БКД) крайне ограничены в связи с тем, что практически в 100% случаев исключение казеина происходит совместно с ограничением в питании глютена, а данные по использованию также противоречивы. A. Piwowarczyk с соавт. наблюдали 214 детей с РАС, половина которых соблюдали БГД и БКД, при этом не отмечали, за редким исключением, статистически значимых различий в основных симптомах патологии между группами детей в зависимости от приверженности к диетотерапии. Однако авторы научной работы установили существенные улучшения в отношении показателей «коммуникация» и «социальное взаимодействие» согласно Гиллиамской шкале оценки аутизма (GARS; Gilliam Autism Rating Scale; Gilliam и соавт., 1995; Рейтинговая шкала аутизма Гиллиама). При анализе по стандартизированной датской схеме показатели «аутичные черты», «общение» и «социальный контакт» у детей, соблюдающих диету, также значительно превышали таковые у обследуемых, не имеющих ограничений в питании. Другие отличия, которые были установлены, касались родительской оценки. При этом не отмечалось негативных последствий от соблюдения диеты [11]. После проведения анализа литературы, имеющейся на 2019 г., C. Millward с соавт. сделали вывод о том, что проведенные ранее научные исследования демонстрируют хорошие результаты использования БГД и БКД у детей с РАС, однако, по мнению ученых, недостаточно данных для того, чтобы включать диетотерапию в курс терапии РАС, необходимо проведение крупномасштабных, рандомизированных контролируемых исследований [12].
K. W. Lange с соавт. проанализировали питание детей с РАС, проживающих в Великобритании. Установлено, что более 80% обследованных используют диетотерапию, при этом практически треть (29%) из них придерживаются БГД/БКД. При этом, со слов родителей, отмечается значительное улучшение основных клинических проявлений заболевания [13]. Опрос 387 родителей пациентов детского возраста с РАС показал, что при использовании БГД/БКД отмечается положительная динамика в поведении детей, их социализации, а также снижение симптомов нарушения со стороны пищеварительной системы в сравнении с опрошенными, не соблюдающими диету [14]. Имеются сведения о том, что существенное значение в отношении эффективности имеет возраст ребенка на момент начала использования диетотерапии [12, 14].
Использование кетогенной диеты (КГД) — относительно недавнее направление в коррекции питания детей с аутизмом. O. El-Rashidy с соавт. обследовали 45 детей в возрасте 3–8 лет, которых разделили на 3 группы по 15 человек в каждой. Первую группу составили пациенты, использующие КГД, вторую — соблюдающие БГД/БКД, а в третью группу включены дети, не имеющие ограничений в питании (контрольная группа). Анализ состояния неврологического статуса, антропометрические данные и оценка по шкалам рейтинга детского аутизма (CARS; Childhood Autism Rating Scale, Schopler et al., 1988; Ранговая шкала детского аутизма) и оценки лечения аутизма (ATEC; Autism Treatment Evaluation Checklist) проведены до начала диетотерапии и через полгода после ее введения детям всех обследуемых групп. В результате обе группы детей, приверженных к диетам, продемонстрировали существенное улучшение показателей ATEC и CARS в сравнении с группой контроля, при этом данные обследования пациентов из 1-й группы превосходили таковые при анализе познавательности и коммуникабельности у детей 2-й группы [15].
При сочетанном соблюдении БГД и КГД в течение 3 месяцев положительную динамику в CARS-2 (Childhood Autism Rating Scale — Second Edition; Schopler и соавт., 2010; Ранговая шкала детского аутизма, вторая редакция) наблюдали в отношении целенаправленных движений, страха или нервозности (р = 0,031, р = 0,008, р = 0,039). Отмечали также взаимосвязь с изменениями показателей в сравнении с базовыми уровнями липопротеинов высокой плотности (ρ = –0,67, p = 0,007) и альбумином (ρ = –0,60, p = 0,019). При использовании сочетания БГД и КГД в течение 6 месяцев, согласно тестированию по ADOS-2 (Autism Diagnostic Observation Schedule — Second Edition; План диагностического обследования при аутизме, второе издание) 10 человек имели достоверно устойчивое улучшение общего показателя ADOS-2 и социального взаимодействия по сравнению с базовыми показателями (p = 0,019; p = 0,023), однако значимого улучшения показателей ограниченного и повторяющегося поведения не было выявлено (p = 0,197) [16].
H. Cekici и N. Sanlier утверждают, что для пациентов с РАС может быть одинаково полезно использование БГД, БКД, КГД, куркумина, верблюжьего молока, пробиотиков и ферментных препаратов. Все это может приводить к нивелированию симптомов РАС, а употребление сахара, пестицидов, добавок, генетически модифицированных продуктов, неорганически обработанных пищевых продуктов и трудноперевариваемых крахмалов может привести к усугублению симптомов патологии [16].
Особенно хочется отметить, что, вводя ограничения в питание детей, нельзя забывать о возможных нарушениях в состоянии нутритивного статуса растущего организма. В литературе неоднократно описывались изменения, возникающие на фоне использования диетотерапии, характерные для детского возраста. Согласно результатам собственных исследований, изменения в состоянии нутритивного статуса у детей и подростков с РАС проявляются у 21,9% пациентов повышением индекса массы тела, а у 18,7% — его снижением. Ожирение 1–2 степени имеют 12,5%, при этом у 6,2% обследуемых определяется белково-энергетическая недостаточность 1-й степени. Снижение уровня сывороточного железа отмечается у 37,3% детей, а общего кальция у 45,1% пациентов. Вышеперечисленные изменения отмечаются равномерно, вне зависимости от приверженности к соблюдению БГД, однако нами выявлены несколько закономерностей. Так, у детей, длительно соблюдающих БГД, показатель сывороточного железа с возрастом достоверно возрастает, в то время как при несоблюдении диеты — незначительно снижается (p
И. А. Бавыкина, кандидат медицинских наук
ФГБОУ ВО ВГМУ им. Н. Н. Бурденко Минздрава России, Воронеж
Значение коррекции питания в терапии расстройств аутистического спектра у детей/ И. А. Бавыкина
Для цитирования: Лечащий врач № 8/2019; Номера страниц в выпуске: 45-47
Теги: дети, аутистические расстройства, питание, диета
Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
1 Кафедра внутренних болезней с основами физиотерапии №2, Нефрологическое отделение ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Ростовское областное патологоанатомическое бюро Министерства здравоохранения Ростовской области, г.Ростов-на-Дону
Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014423 Эл.почта: batjushin-m@rambler.ru, sadovnichaya@list.ru, nephr-roon@rambler.ru
За прошедшее десятилетие отмечен значительный рост популярности «нетрадиционной медицины». Это объясняется такими факторами, как неудовлетворенность методами и эффективностью ранее проводимого лечения, бесконтрольным использованием информации о неблагоприятных побочных действиях фармацевтических препаратов, ростом цен на фармакопейные лекарственные средства и низким уровнем общей культуры населения. В отношении использования сбора лекарственных растений в литературе имеются указания на ограничения их применения, так как их прием при определенных заболеваниях может вызывать нежелательные побочные эффекты. В Европе, США и Канаде постоянно увеличивается доля населения, регулярно использующего фитотерапевтические средства и биологически активные добавки, в странах Азии и Африки более 30% всех случаев острого почечного повреждения развивается как осложнение лечения растительными препаратами [1, 2]. По данным исследования импортированных патентованных азиатских аюрведических растительных продуктов в Калифорнии, было установлено, что 32% из них содержали не декларированные фармацевтические средства и тяжелые металлы (свинец, ртуть, кадмий, мышьяк). Среди не декларированных веществ наиболее часто встречаются: эфедрин, хлорфениламин, колхицин, метилтестостерон, глюкокортикостероиды, нестероидные противовоспалительные препараты [3, 4, 5, 6, 7, 8]. Сегодня в Европе зарегистрировано более 100 препаратов, содержащих растительные флавоноиды. Они обладают антиоксидантной активностью и применяются в основном в лечении нарушений периферического кровообращения.
Потенциальное значение этой проблемы чрезвычайно велико, в частности остается неясной степень взаимодействия фармацевтического препарата с травами и растительными продуктами [9, 10]. Неконтролируемый прием лекарственных трав может превышать потенциальный положительный эффект, особенно среди лиц с заболеваниями почек [11, 12, 13, 14], что связано с непосредственным воздействием растительных препаратов на клетки канальцев и их активной реабсорбцией с достижением высокой концентрации в мозговом слое. Результатом такого воздействия на почки является острое канальцевое повреждение, папиллярный некроз, острый и хронический интерстициальный нефрит, синдром Фанкони, нефролитиаз, артериальная гипертензия, рабдомиолиз [15, 16].
К фитотоксинам, обладающим прямым нефротропным действием относят аристохолиевую кислоту, сапонины, метилсалицилат, флавоноиды, ореллаин, алкалоиды эфедры, охратоксин [17]. На территории России наиболее часто с целью лечения и профилактики заболеваний почек применяются такие лекарственные травы как: пижма, барбарис, берѐза, бессмертник песчаный, брусника, бузина, календула, кукуруза (рыльца), можжевельник, толокнянка, хвощ, шиповник, репешок обыкновенный (Argimonia Eupatoria), а также марена красильная грузинская (Rubia tinctorum var. iberica), дикорастущая трава.
Репешок обыкновенный (Argimonia Eupatoria) – многолетнее травянистое растение, широко распространенное в европейской части России, на территории Западной и Восточной Сибири, Дальнего Востока [18]. В народной и традиционной медицине все части растения применяются при широком спектре заболеваний в качестве желчегонного, противовоспалительного, антиаритмического, гипогликемического, антигельминтного, анальгетического, гемостатического, антигипертонического, антитоксического и антиканцерогенного средства. В европейских странах некоторые виды Agrimonia являются официальными лекарственными растениями и используются в практической медицине как вяжущее, противовоспалительное средство [19]. При проведении биохимического анализа структуры растения в надземной части A.Eupatoria обнаружены вещества фенольной природы (филавоноиды, дубильные вещества, кумарины, изокумарины, оксикоричные кислоты), тритерпеноиды, эфирное масло, полисахариды и др., а в подземных органах растения обнаружены медь, цинк, железо, ванадий, никель, хром, титан, марганец, стронций, цирконий, серебро [20].
Токсические эффекты А. Eupatoria в большей степени связаны не со специфическими токсикантами, а с наличием в нем большого количества гликозидов кумарина и его метаболитами. В 1994 г. на основании углубленного анализа токсикологических исследований экспертами Европейского Совета сделаны рекомендации о снижении допустимого уровня содержания кумарина в продуктах питания до 0,5 мг/кг вследствие его канцерогенного и мутагенного действия.
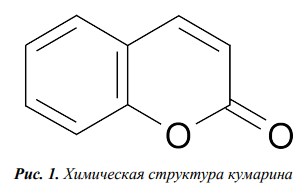
КУМАРИН (2-хроменон) имеет молекулярную массу 146,14 и представляет собой бесцветные кристаллы с запахом свежего сена и горьким вкусом (рисунок 1).
Рис. 1. Химическая структура кумарина
Сообщения о гепатотоксических эффектах для человека, развивающихся вследствие приема кумарин-содержащих лекарственных препаратов, часто противоречивые, вызвали значительный интерес исследователей к изучению его метаболизма и механизма токсического действия [20, 21].
Современные представления о метаболизме кумарина предполагают наличие двух основных путей трансформации данного соединения в организме млекопитающих. Первый этап трансформации кумарина реализуется по двум направлениям: в результате 7-гидроксилирования кумарина образуется малотоксичный 7-гидроксикумарин, элиминирующийся из организма млекопитающих с мочой; в процессе 3-гидроксилирования образуется 3-гидроксикумарин, промежуточным метаболитом в данном процессе является токсичный 3,4-эпоксид, подвергающийся дальнейшей трансформации с образованием о-гидроксифенилальдегида, окисляющегося до о-гидроксиэтанола и о-гидроксифенилуксусной кислоты. Рядом авторов было показано, что доминирование одного из двух направлений метаболизма кумарина в организме обусловливает межвидовые различия в проявлении гепатотоксических свойств данного соединения [22, 23]. Риск осложнений при приеме кумарина возрастает при сочетанном приеме НПВС, антикоагулянтов прямого и непрямого действия.
В экспериментальных работах [24, 25] установлено, что кумарин при однократном введении в больших дозах крысам вызывает центрилобуллярный некроз гепатоцитов. Это свидетельствует о том, что метаболизм кумарина [3-l4C] в данном случае проходил с образованием более токсичных метаболитов. Исследования in vitro показали, что химически активные [3-l4C]-кумариновые метаболиты, образующиеся при участии цитохром P450-зависимых энзимов, способны ковалентно связывать микросомальные протеины [26]. Было сделано предположение, что токсическим метаболитом в данном случае может выступать 3,4-эпоксид.
Нами представлен случай нефротоксического действия алкалоидов кумарина и его метаболитов при употреблении отваров и настоев Репешка обыкновенного.
Пациентка А. 43 лет, поступила в нефрологическое отделение клиники РостГМУ с жалобами на легкую ноющую боль в поясничной области с обеих сторон, усиливающуюся при физической нагрузке, пастозность голеней и стоп, периодически повышающееся артериальное давление до 220/140 мм рт. ст., не связанное с психоэмоциональными и/или физическими нагрузками, сопровождающееся головной болью и головокружением. Из анамнеза известно, что в 1990 году в течение всего периода первой беременности выявлялась протеинурия до 3,3 г/л, не сопровождающаяся отечным синдромом и артериальной гипертензией, в течение 5 лет после родов протеинурия сохранялась на уровне 0,5-1,0 г/л. В 1995 г. впервые зарегистрирован высокий уровень артериального давления (АД) – 150/100 мм рт. ст. Антигипертензивную терапию не получала, однако с 1999 г. артериальная гипертензия приобрела злокачественный характер, с повышением уровня системного АД до 200/120 мм рт. ст., по поводу чего в 2000 году проходила обследование в стационаре, где был поставлен диагноз гипертонической болезни II стадии, 3 степени, риск 3 (высокий), тогда же была подобрана антигипертензивная терапия, позволявшая контролировать АД на уровне 130-150/80-90 мм рт. ст., но пациентка данные рекомендации не соблюдала, а самостоятельно приобрела фитопрепарат (Репешок обыкновенный), отвар и настои которого, принимала более полугода непрерывно по несколько раз в сутки. В 2001 году, во время прохождения планового медицинского осмотра выявлен нефросклероз справа, дальнейшего наблюдения и лечения не проходила. В 2008 году при выполнении ультразвукового исследования почек выявлен конкремент правой сморщенной почки, по данным реносцинтиграфии функция правой почки отсутствует.
Помимо приема фитопрепаратов постоянно использует дипиридамол в дозе 75 мг/сутки, эналаприл 10 мг/сутки с 2001 года, в 2011 году уровень протеинурии составил 0,044 г/л, уровень артериального давления до 240/140 мм ртутного столба.
По данным клинико-лабораторного обследования в нефрологическом отделении клиники РостГМУ со стороны ОАК на себя обращали внимание ускорение СОЭ до 32 мм/час, признаки анемии легкой степени тяжести (эритроцитов 2,52х1012/л, гемоглобин 100 г/л), снижение количества тромбоцитов (75х103 /л), со стороны свертывающей системы крови по данным коагулограммы выявлены признаки гипокогуляции, характеризующиеся снижением АПТВ до 20 сек., протромбиновое время 10 сек., МНО 0,5, тромбиновое время 6 сек., фибриноген 1,98 г/л, со стороны биохимических показателей крови отмечалась гиперхолестеринемия до 10,79 мМ/л, гиперазотемия (креатинин крови 129 мкМ/л, мочевина 14,9 мМ/л), уровень АСТ достигал 68 Ед/л, АЛТ – 51 Ед/л. В ОАМ – протеинурия, характерная для нефритического синдрома (до 0,4 г/л). Снижение концентрационной функции почек, проявляющееся снижением СКФ до 45,5 мл/мин (по формуле MDRD), изостенурией (по данным пробы Фольгарда). Суточная протеинурия не превышала 0,495 г/сутки, по данным суточной экскреции солей с мочой отмечается высокая экскреция кальция до 9,73 мМ/сутки, и мочевой кислоты до 9,13 мМ/сутки. За все время наблюдения состояние пациентки оставалось стабильным, уровень АД в пределах 130-140/70-80 мм рт. ст., суточный диурез около 1500-1700 мл. По данным УЗИ почек отмечаются диффузные изменения паренхимы почек, уменьшение размеров, микролит правой почки.
Таким образом, клиническая картина болезни соответствовала аутоиммунному заболеванию почек, на что указывали наличие протеинурии, мочевой синдром, характеризующийся микрогематурией, снижением азотвыделительной функции почек, наличием артериальной гипертензии, тем не менее, нельзя было исключить наличие хронического повреждения канальцевого эпителия, преимущественно в проксимальных отделах, с нарушением реабсорбции, без формирования клиники острого канальцевого некроза, что позволило заподозрить наличие специфического патологического процесса, связанного с токсическим влиянием метаболита кумарина на канальцевый эпителий почек. Следует также учесть наличие процесса нефросклероза в правой почке, вероятно, обусловленного мочекаменной болезнью в анамнезе.
Пациентке была выполнена пункционная нефробиопсия левой почки с последующим морфологическим исследованием биоптата с целью верификации патологического процесса и определения тактики терапии. В результате получены следующие данные.
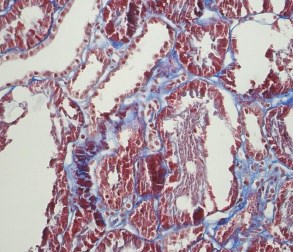
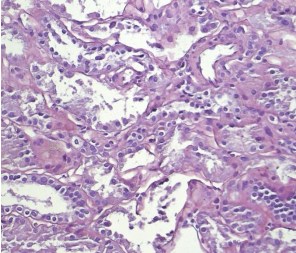
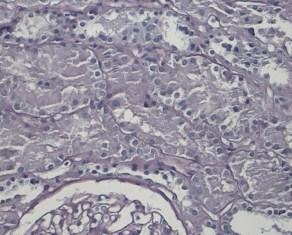
Светооптически 1 из 9 клубочков склерозирован полностью, остальные гипертрофированы. В одном клубочке выраженная интракапиллярная гиперклеточность и пролиферация базальных мембран. Остальные клубочки не имеют признаков выраженных пролиферативных изменений, за исключением сегментарного расширения парамезангиальных зон. Сегментарного склероза капиллярных пучков не наблюдается. В интерстиции слабый диффузный и мелкоочаговый фиброз. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации (рисунки 2, 3, 4).
Рис. 2. Х20 массон1 – резко выраженные дистрофические изменения эпителия канальцев, его слущивание
Рис. 3. Х20 ШИК – резко выраженные повреждения эпителия канальцев – слущивание фрагментов цитоплазмы и целых клеток в просвет канальцев
Рис. 4. Х20 ШИК – расширение и гиперклеточность мезангиальных зон
Окраска на амилоид отрицательна. Иммуноморфологически: IgA в клубочках: отрицательно, в канальцах: отрицательно, IgG в клубочках: отрицательно, в канальцах: отрицательно, IgM в клубочках: единичное редкое пунктирное, в канальцах: единичные цилиндры, C3 комплимент: единичные зерна в клубочках и в капсуле, а также зернистое в стенках артериол, C1q комплимент: отрицательно. Каппа: отрицательно в клубочках, единичные очаги в интерстиции. Лямбда: отрицательно в клубочках, единичные очаги в интерстиции. Электронномикроскопически: толщина и структура базальных мембран в пределах нормы, депозитов не обнаружено. Имеются протяженные очаги распластывания малых отростков подоцитов, пролиферация мезангиальных клеток отсутствует. Результаты были интерпретированы как очаговое распластывание малых отростков подоцитов, а также тубулопатия неясного генеза. Особое внимание в клинической картине на себя обращало постепенное нарастание протеинурии, артериальной гипертензии на фоне снижения фильтрационной функции почек и канальцевой дисфункции. Подобная двойственность клинических проявлений препятствовала пониманию сути патологического процесса в почках, и не позволяла в полной мере проводить медикаментозную терапию, отвечающую патогенетическим и этиологическим принципам. Указание в анамнезе на длительный прием фитопрепаратов позволило предположить токсическое воздействие метаболитов кумарина на функциональное состояние почек, однако в доступной литературе нет прямых указаний на прямое нефротоксическое действие кумарина. Исследователи ограничивают область токсических влияний кумарина и его метаболитов на функцию печени и гемостаза. Действительно, в рассматриваемом клиническом примере отмечаются как нарушения гемостаза, характеризующиеся гипокоагуляцией, так и печеночная дисфункция. Однако по данным нефробиопсии отмечаются признаки токсического процесса на уровне канальцев почки, характеризующегося резко выраженной гидропической дистрофией эпителия канальцев вплоть до вакуолизации, слабым диффузным и мелкоочаговым фиброзом интерстиция. Эти изменения соотносятся с изменениями клубочков, характеризующимися выраженной интракапиллярной гиперклеточностью и пролиферацией базальных мембран, сегментарным расширением парамезангиальных зон, наличием очагов распластывания малых отростков подоцитов.
Таким образом, впервые в литературе описан случай прямого нефротоксического воздействия кумарина и его метаболитов. Повреждение канальцевого эпителия почек метаболитами кумарина обуславливается во многом изначальным повреждением гломерулярной базальной мембраны, а также дисморфизмом подоцитов, что обуславливает повышенную готовность канальцевого эпителия к повреждению на фоне усиления процессов реабсорбции в связи с дефектами гломерулярной базальной мембраны и подоцитов. В свою очередь, низкая молекулярная масса кумарина и его метаболитов позволяет свободно проникать через гломерулярный фильтр, что, в условиях повреждения базальной мембраны и подоцитов, приводит к критическому повышению его в первичной моче и обуславливает токсическое действие на уровне канальцев почки.
Литература
1. Ермоленко, В.М. Острая почечная недостаточность / В.М. Ермоленко, А.Ю. Николаев – М.: Гэотар-Медиа, 2010. – 400 с.
2. Angell, M. Alternative medicine – the risks of untested and unregulated remedies / M. Angell, J.P. Kassirer // N. Engl. J. Med. – 1998. – V.339. – P.839-841.
3. Fugh-Berman, A. Herb-drug interactions / A. Fugh-Berman // Lancet. – 2000. – V.355. – P.134-138.
4. Recent patterns of medication use in the ambulatory adult population of the United States: the Spone survey / D.W. Kaufman, J.P. Kelly, L. Rosenberg et al. // JAMA. – 2002. –V.287. – P.337-344.
5. Screening methods for drugs and heavy metals in Chinese patent medicines / A. Au, R. Ko, F. Boo et al. // Bull. Environ. Contam. Toxicol. – 2000. – V.5. – P.112-119.
6. Chopra, A. Ayurvedic medicine: core concept, therapeutic principles, and current relevance/ A. Chopra, V. Doiphode. // Med. Clin. North. Am. – 2002. – V.86. – P.75-89.
7. Ernst, E. Heavy metals in traditional Indian remedies / E. Ernst // Eur. J. Clin. Pharmacol. – 2002. – V.57. – P.891-896.
8. The use and safety of non-allopathic Indian medicines / N. Gogtay, H. Bhatt, S. Dalvi, N. Kshirsagar // Drug Saf. – 2002. – V.25. – P.1005-1019.
9. Indian herbal remedies for diabetes as a cause of lead poisoning / R.W. Keen, A.C. Deacon, H.T. Delves et al. // Postgraduate Medical Journal. – 1994. – V.70. – P.113-114.
10. Ko, R.J. Adulterants in Asian patent medicines / R.J. Ko // N. Engl. J. Med. – 1998. – V.339. – P.847.
11. Arlt, V. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review / V. Arlt, M. Stiborova, H. Schmeiser // Mutagenesis. – 2002. – V.17. – P.265-277.
12. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey / D.M. Eisenberg, R.B. Davis, S.L. Ettner et al. // JAMA. – 1998. – V.280. – P.1569-1575.
13. Ernst, E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review / E. Ernst // J. Intern. Med. – 2002. – V.252. – P.107-113.
14. Foote, J. Medicinal herb use and the renal patient / J. Foote, B. Cohen // J. of Renal Nutrition. – 1998. – V.8. – P.40-42.
15. International Agency for Research on Cancer (IARC). Some traditional herbal medicines, some mycotoxins, nafhtalene and styrene. In IARC Monographs on the Evaluation of Carcinogenic Risks of Chemicals to Humans. Lyon. France: IARC, 2002. – Р.82.
16. Herbs and the kidney/ C. Isnard Bagnis, G. Deray, A. Baumelou et al. // Am. J. Kidney Dis. – 2004. – V.44. – №1. – P.1-11.
17. Morris L. Side-effects of coumarin / L. Morris, P.D. Welsby // Postgrad. Med. J. – 1995. – №71. – P.701-702.
18. British Herbal Pharmacopoeia. – 1996. – 212 p.
19. Advances in research on chemical constituents and pharmacological activities of Agrimonia pilosa / G. Hong, Y.H. Dai, P.X. Liu et al.// Pharm. Care and Research. – 2008. – V.8. – № 5. – P.362-366.
20. Карташова, Г.С. Содержание дубильных веществ в Agrimonia pilosa Ledeb. / Г.С. Карташова, И.В. Гравель, Е.Г. Таран // Растительные ресурсы. – 1991. – Т.27. – №1. – С.139-143.
21. Wei, Y. Isolation of hyperoside and luteolin-glucoside from agrimonia pilosa ledeb using stepwise elution by high-speed countercurrent chromatography / Y. Wei, Y. Ito // J. of Liquid Chromatography and Related Technologies. – 2007. – V.30. – №9-10. – P.1465–1473.
22. Separation and determination of flavonoids in Agrimonia pilosa Ledeb. by capillary electrophoresis with electrochemical detection / X. Xu, X. Qi, W. Wang, G. Chen // J. of Separation Science. – 2005. – V.28. – №7. – P.647-652.
23. Analysis of the volatile components of Agrimonla Pilosa Ledeb by gas chromatography-mass spectrometry / Y.W. Li, L.F. Huang, C. Liang et al. // J. of Central South University (Science and Technology). – 2007. – V.38. – №3. – P. 502-506.
24. Фитохимическое исследование растений флоры Сибири / Д.Л. Макарова, В.В. Величко, Н.Е. Ким и др.// Фармация. – 2008. – №3. – С.19-22.
25. 500 важнейших лекарственных растений / В.К. Лавренов, Г.В. Лавренова. – М., 2003. – 510 с. 26. Comparative metabolism and kinetics of coumarin in mice and rats / S.L. Born, A.M. Api, R.A. Ford et al. // Food Chem. Toxicol. – 2003. – №41. – P.247-258.
Статья опубликована в журнале «Вестник урологии». Номер №3/2013 стр. 30-39