щелочные или марганцево цинковые какие батарейки лучше
Щелочные батарейки против цинковых: какие лучше всего покупать?
Какие батарейки следует использовать в устройствах с низким энергопотреблением, таких как пульт телевизора или часы? И какие из них идеально подходят для смартфона? Какие лучше всего выбрать батарейки: цинковые или щелочные? В чем главное отличие обеих батарей? Об этом нам расскажет сотрудник интернет-магазина http://gpbatteries.com.ua/, в котором вы непосредственно можете купить высококачественные щелочные батарейки GP.
Щелочные батарейки vs цинковые?
Основное различие между цинковой и щелочной батарейкой заключается в типе электролита, используемого в обеих батареях. Цинковые батареи в основном состоят из хлорида аммония, в то время как щелочные батареи используют гидроксид калия. Тем не менее, эти технические характеристики не говорят много об использовании батарей. Вот почему мы сейчас собираемся более внимательно изучить емкость, преимущества и области применения цинковых и щелочных батарей.
Вместимость
Как и ожидалось, емкость обеих батарей разная. Из-за состава щелочная батарея обеспечивает больше энергии, чем цинковая. Единственным следствием этого является то, что обе батареи должны использоваться в разных приложениях.
Преимущества щелочных батареек
Техника
Поскольку щелочные батареи обеспечивают больше энергии, чем цинковые, вы можете использовать щелочные элементы для такихприборов, как: электрические зубные щетки, игрушки и игровые гаджеты.
Преимущества цинковых батареек
Техника
Эти батареи являются надежным источником питания для приборов, которые потребляют мало энергии. В таких устройствах, как: пульты дистанционного управления для телевизора, часы, детекторы дыма и фонари, вы должны использовать цинковые батареи из-за низкого энергопотребления. Это приведет к возможности использовать приборы в течение более длительного времени за те же деньги.
Алкалиновые или литиевые батарейки – какие лучше выбрать?
В этой статье будут рассмотрены особенности алкалиновых и литиевых батареек, а также их преимущества и недостатки. Для педантов сразу отмечу, что под обозначением «батарейки» здесь понимаются первичные источники тока щелочного (alkaline) и литиевого типа. В основном они представлены в продаже цилиндрическими моделями форм-фактора AA (или R6) и AAA (или R3), но на самом деле типоразмеров значительно больше. Можно также назвать C (R14), D (R20). Есть не только цилиндрические, но также дисковые (CR) или призматические («Крона» 9 В). Отличия у них не в форме и размерах, а в типе электрохимической системы, которая и определяет их достоинства и недостатки.
Алкалиновые
Конструкция и состав
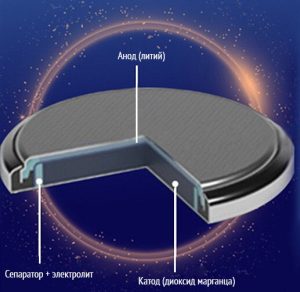
Это стандартные батарейки щелочного типа. Алкалиновыми их окрестили за маркировку «Alkaline» (в переводе щелочной) импортного происхождения. Это марганцево─цинковый гальванический элемент питания со щелочным электролитом. В большинстве случаев щелочные батарейки имеют катод из двуокиси марганца (MnO2) с графитосодержащим материалом, а анод из цинковой пасты (Zn). Реже в качестве материала катода применяются оксид серебра (Ag2O) или метагидроксид никеля (NiO(OH)). В качестве электролита применяется гидроксид калия (KOH).
Ниже можно посмотреть конструкцию щелочного источника питания цилиндрического типа.
Изоляцию катода обеспечивает оболочка, предотвращающая короткое замыкание. В нижней части можно также увидеть специальную прокладку. Её роль заключается в принятие газов, образующихся в элементе при работе. Если давление превышает допустимый предел, то развивается предохранительная мембрана и батарейка разгерметизируется. В результате из алкалинового источника питания может вытечь электролит.
Реакции
В алкалиновых источниках питания протекают следующие реакции.
На аноде идет реакция с образованием гидроксида цинка и дальнейшим его разложением на оксид цинка и воду.
Zn + 2OH − => Zn(OH)2 + 2e −
На катоде восстанавливается оксида марганца.
Общий электрохимический процесс в алкалиновой батарейке выглядит следующим образом.
Zn + 2KOH + 2MnO2 + 2e − → 2e − + ZnO + 2KOH + Mn2O3
Конструкция и материалы щелочной батарейки очень близки к солевым источникам питания. Однако в отличие от солевых батареек, в алкалиновых цинк содержится в порошкообразном виде, а не в форме цинкового стакана.
Сферы применения
Ниже перечислены основные сферы применения.
Как видите, это устройства, потребляющие относительно высокий ток непродолжительное время, а также те, что требуют небольшое по мощности питание в течение длительного времени. Если подать слишком высокую нагрузку, то может просесть напряжение и потребуется некоторое время на его восстановление.
Вернуться к содержанию
Основные параметры
Литиевые
Конструкция
В случае с литиевыми батарейками есть несколько распространённых типов конструкции. Ниже рассмотрены цилиндрические и дисковые источники тока.
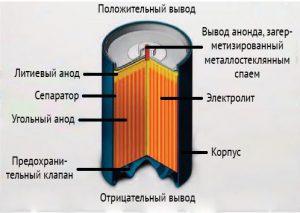
Для цилиндрических моделей применяются бобинная и рулонная конструкция.
В случае рулонных батареек важно позаботиться о безопасности, поскольку при коротком замыкании (КЗ) ток в них может достигать 20 ампер. Если произойдет КЗ, то из-за сильного разогрева элемент питания может взорваться. Чтобы это предотвратить, конструкции предусматривается плавкий термистор, который еще называют плавким предохранителем. Когда ток превышает определенное значение, термистор разогревается, увеличивается сопротивление материала и ток КЗ снижается.
После устранения короткого замыкания и уменьшения температуры, сопротивление плавкого предохранителя снижается и батарейку можно снова использовать.
Некоторые производители предусматривают дополнительный вид защиты в виде специальной насечки в основании отрицательного вывода элемента. Если давление внутри корпуса превысит определенное значение, то по этой насечке произойдет вскрытие и сброс давления. Так удастся избежать взрыва. После вскрытия литиевая батарейка уже непригодна для использования.
Состав и протекающие реакции
Существуют две электрохимические системы, на основе которых создаются литиевые батарейки.
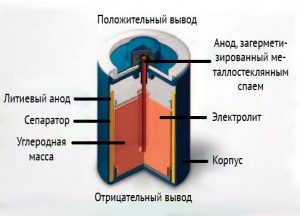
Литий─тионилхлоридные
В этой электрохимической системе катодом является жидкое вещество. В роли анода выступает металлический литий, а катод выполнен из пористой углеродной массы. Электролит представляет собой раствор солей лития (LiGaCl4 или LiAlCl4) в тионилхлориде (SOCl2). Тионилхлорид, помимо функции электролита, выполняет также роль активного материала катода. Химическая реакция, протекающая в этой электрохимической системе, выглядит так.
В процессе разряда происходит оседание хлорида лития в порах катода. Когда батарейка близка к полному разряду, начинается оседание серы на катоде. Параллельно происходит растворение оксида серы в электролите.
Литий─диоксидмарганцевые
Электрохимические системы на базе MnO2 являются более распространенными при создании первичных источников тока литиевой типа. Здесь роль анода также выполняет металлический литий, активным катодным материалом является термообработанный диоксид марганца ─ MnO2. В системе используются органический электролит, имеющий в своём составе растворенные соли лития LiClO4 или LiCF2SO2. Часто используется диметоксиэтан или пропиленкарбонат. Реакция, происходящая при разряде в этой системе, показана ниже.
При протекании реакции нет образования каких-то химических элементов, которые бы увеличивали давление в корпусе источника тока. Марганец восстанавливается до трёхвалентного состояния, а также происходит встраивание ионов лития в кристаллическую решётку MnO2.
Система на основе Li─SOCL2 имеет более высокую энергетическую плотность и ёмкость, чем Li─MnO2. Естественно, при одинаковых габаритах и массе. Это обусловлено более высокой активностью тионилхлорида сравнению с диоксидом марганца. Кроме того, номинальное напряжение в первом случае составляет 3,5, а во втором 3 вольта.
Если после хранения такой батарейки подключить её к устройству, потребляющему большой ток, то произойдет кратковременная просадка напряжения. Впоследствии она выравнивается до нормального значения. Просадка будет тем сильнее, чем дольше на хранении находился источник питания. И тем больший ток будет потребляться нагрузкой. Если же напряжение снизится ниже минимального, то устройство не может просто включиться.
Поэтому после хранения батареек Li─SOCl2 перед подключением к ним нагрузки нужно проводить депассивацию. Причём специалисты советуют учитывать эффект пассивации на стадии проектирования того или иного устройства для его стабильного функционирования. С этой точки зрения процесс пассивации является отрицательным явлением.
В принципе, этот эффект можно преодолеть, если ввести в электролит вещества, способствующие растворению хлорида лития. Но образующаяся пленка имеет и положительный эффект. Он заключается в том, что при хранении предотвращается окисление материала катода. Благодаря этому снижается интенсивность саморазряда. К примеру, у батареек Li─SOCl2,имеющих бобинную конструкцию, составляет всего около 1 процента в год.
Вернуться к содержанию
Сферы применения
Безопасность
При использовании литиевых батареек важное значение приобретает вопрос безопасности. Это касается их применения как в промышленных, так и в бытовых устройствах. Нужно позаботиться о том, чтобы параметры эксплуатации не привели к возгоранию, порче оборудования и травмам персонала. Более безопасными считаются источники тока Li─MnO2. В них при хранение и разряде не возникает никаких элементов, увеличивающих давление в корпусе. В электрохимических системах Li─SOCl2 присутствуют подобные элементы, но критического увеличения давления они не вызывают.
Стоит также понимать, что чем больше ёмкость литиевых источников тока (а значит, больше их размеры и масса), тем больше в них активного материала. А значит, серьёзнее будут последствия в случае возгорания. Чем меньше лития использовано в батарейке, тем она безопаснее. Про средства защиты (клапаны, насечки) уже было сказано выше в разделе про рулонную конструкцию.
Характеристики
| Li─MnO2 | Li─SOCl2 | |
|---|---|---|
| Катод | диоксид марганца | тионилхлорид |
| Электролит | перхлорат лития в растворителе (пропиленкарбонат, диметоксиэтан) | тетрахлоралюминат лития в тионилхлориде |
| ЭДС, В | 3.3 | 3.65 |
| Номинальное напряжение, В | 3 | 3.5 |
| Удельная энергия, Вт*ч/кг | 280 | 500-700 |
Что лучше – литиевые или алкалиновые?
В итоге, что лучше литиевые или щелочные батарейки? Как и в других подобных случаях, однозначного ответа на вопрос здесь дать нельзя. Выбор нужно делать в зависимости от устройства, где будет работать батарейка. Можно только обозначить преимущества и недостатки обоих типов.
Можно однозначно сказать, что выбор в пользу литиевых батареек следует делать тогда, когда требуется обеспечить питание устройств с высоким потреблением тока. Но при этом придется потратиться больше, чем случае со щелочными источниками тока.
Вернуться к содержанию
Марганцево-цинковые батарейки
Солевые батарейки
для производителя:
— дешевизна и доступность сырья
— простота технологии производства
для покупателя:
— низкая конечная стоимость, определенная низкими затратами производителя;
— удобство использования;
— удовлетворительные для большинства облостей применения электрические параметры.
Именно соотношение цены и качества дало возможность им почти полтора века удерживать пальму первенства. Но все-таки в последнее время многие производители неуклонно сокращают их производство или полностью отказываются от их выпуска, что объясняется повышением требований производителей современного электронного оборудования к электрическим параметрам источников питания.
К числу недостатков солевых батареек относятся:
— резкое падение напряжения в течении разряда;
— значительное снижение отдаваемой емкости при увеличении разрядных токов до значений, необходимых для современных устройств;
— резкое ухудшение характеристик при отрицательных температурах;
— маленький срок хранения (порядка двух лет).
Понятие «номинальная емкость» редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации.
Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
На работоспособность солевых марганцево-цинковых элементов существенно сказывается время их хранения с момента изготовления. Саморазряд их определяется, главным образом, коррозией цинкового электрода, а также взаимодействием активных масс положительного электрода с загустителями электролита. В зависимости от рецептур активных масс и электролита, конструктивного исполнения и размеров элементов их сохранность колеблется от 1 года до 3 лет. К концу гарантированного срока утрата емкости может составлять 30-40 %.
Электроды и электролит. Активная масса положительного электрода (называющаяся «агломерат») состоит из смеси диоксида марганца с чешуйчатым графитом либо ацетиленовой сажей и электролитом. При этом технология изготовления MnO 2 заметно сказывается на электрических характеристиках элементов. Графит и сажа увеличивают электрическую проводимость активной смеси. Их массовая доля составляет 8-20% в зависимости от назначения источника тока. Чем выше разрядные токи, на которые рассчитан марганцево-цинковый элемент, тем выше содержание токопроводящих добавок. Для повышения степени использования окислителя активную массу пропитывают раствором электролита.
Отрицательный электрод изготовляется из коррозионно-стойкого цинка высокой степени чистоты (массовая доля цинка 99,94% и более). Цинк содержит маленькое количество свинца, галлия или кадмия (десятые или сотые доли процента), которые являются ингибиторами коррозии цинка.
При использовании хлорида аммония электродные процессы описываются следующим уравнением токообразующей реакции:
2MnO 2 + 2NH 4 Cl + Zn → ZnCl 2 · 2NH 3 + H 2 O + Mn 2 O 3
При использовании хлорида цинка уравнение имеет вид:
8MnO 2 + 4Zn + 2ZnCl 2 + 9H 2 O → 8MnOOH + ZnCl 2 · 4ZnO · 5H 2 O
Энергетические показатели элементов с хлоридно-цинковым электролитом существенно выше: при средних и повышенных токах нагрузки они могут обеспечить в 1,5-2 раза большую длительность работы. Работоспособность их при пониженных температурах тоже выше.
Конструкция солевых батареек

Конструкция солевой батарейки
Щелочные (Алкалиновые) батарейки
Для замедления коррозии раньше использовалось амальгамирование как объемное, так и поверхностное. После введения ограничений на применение ртути, применяются цинковые порошки высокой степени чистоты, легированные определенными металлами, а также органические ингибиторы коррозии.
Активная масса анода содержит цинк (объемная доля 18-33 %), загуститель (гель-компонент), раствор электролита, оксид цинка и ингибитор коррозии (см. таблицу). В качестве гель-компонента используют производные целлюлозы, полиакрилаты, поливиниловый спирт и другие полимеры.
Типичный состав анодной массы щелочной батарейки
| Компонент | Содержание (масс. %) |
| Порошок цинка | 55-75 |
| Раствор KOH (32-55%) | 25-45 |
| Оксид цинка | до 2 |
| Загуститель | 0,4-2 |
| Ингибитор коррозии | до 0,05 |
Активная масса катода содержит кроме диоксида марганца, графит либо ацетиленовую сажу, раствор KOH и связующее (см. таблицу). Содержание компонентов в активной массе катода у различных изготовителей может колебаться в широком диапазоне. Например, содержание углеродистых материалов может достигать 15 % и выше.
Типичный состав катодной массы щелочной батарейки
| Компонент | Содержание (масс. %) |
| Диоксид марганца | 79-85 |
| Углерод | 7-10 |
| Раствор KOH (35-55%) | 7-10 |
| Связующее | 0-1 |
В качестве электролита применяются концентрированные растворы KOH (иногда NaOH) с добавками ZnO, а иногда и LiOH. Электролит загущен природными или синтетическими полимерными соединениями, содержащими OH-группы.
В начале процесса разряда происходит окисление цинка с образованием цинката ZnO 2 2- (или Zn(OH) 4 2- ). После насыщения раствора электролита цинкатом, начинается вторичный процесс:
Гарантийный срок хранения щелочных элементов составляет 5-7 лет, иногда он достигает 10 лет.

Разрядные кривые марганцево-цинкового элемента при разных токах разряда: а-солевого, б-щелочного
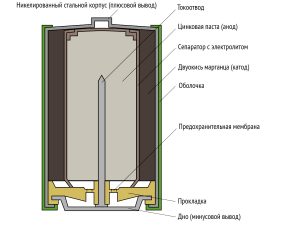
Конструкция щелочных батареек

Устройство щелочной батарейки:
1-катод, 2-сепаратор с электролитом, 3-корпус, 4-футляр, 5-токоотвод, 6-анод, 7-дно, 8-прокладка
Из-за более плотной активной массы и применения стального корпуса щелочные батарейки при тех же размерах обычно тяжелее солевых на 25-50 %.
Емкость и энергия щелочных батареек. Как и у всех химических источников тока, емкость батареек с щелочным электролитом уменьшается при увеличении тока разряда и снижении температуры, но менее резко, чем у элементов с солевым электролитом. Удельная емкость элементов с щелочным электролитом при разряде малыми токами приблизительно в 1,5 раза превышает удельную емкость элементов с солевым электролитом. При разряде большими токами это различие достигает 4-10-кратного.
Емкость источника тока при прерывистом разряде средними и большими нормированными токами выше, чем при непрерывном разряде. Но при прерывистом разряде малыми токами емкость источника тока меньше емкости при непрерывном разряде вследствие саморазряда.
Во всем мире в производстве наблюдается стабильная тенденция по росту доли более энергоемких щелочных марганцево-цинковых элементов.
Следует еще раз особо подчеркнуть, что для уменьшения саморазряда элементов в настоящее время используются не ртуть и кадмий, а другие ингибиторы коррозии цинка которые менее токсичны.
Алкалиновые батарейки: технические характеристики, виды, область применения и отличие от солевых батареек
Аккумуляторы и батарейки питают бытовые устройства, которые работают автономно от электрической сети: пульты управления, фонарики, кухонные весы, часы или детские игрушки. Действие электрического тока отличается для разных электролитов в их составе. Долгим сроком службы и надежностью отличаются щелочные или алкалиновые батарейки, тогда как солевые элементы питания разряжаются быстрее.
История развития
Предок современных батареек — вольтов столб — был изобретен в начале 19 в. итальянским ученым Алессандро Вольта. В составе первого в мире автономного источника питания поочередно соединялись медные и цинковые пластинки — гальванические элементы. Электрический ток возникал из-за химического взаимодействия металла с солевым раствором.
Современные устройства отличаются меньшими размерами и улучшенной производительностью, но имеют такой же принцип действия.
Массовое производство электрических элементов питания началось в середине 19 в. во Франции инженерами Жоржем Лекланше и Эрнестом Барбье. Тогда их применяли в оборудовании телеграфных сетей и железных дорог.
Первый источник тока в промышленных батареях — марганцево-цинковый с солевым раствором — был разработан Лекланше. Позднее в производстве стали пользоваться другими первичными элементами анода и катода, экспериментировать с составом электролита, чтобы уменьшить размеры корпуса, но увеличить удельную емкость и срок службы батареек.
Щелочной раствор для химического взаимодействия анода и катода впервые использовали в 20 в. Томас Эдисон и Вальдемар Джангнер, но работали изобретатели независимо друг от друга. В 1950 г. канадский инженер Льюис Урри применил щелочь для марганцево-цинковых батареек, а уже через 10 лет запатентовал эту разработку.
Щелочные и алкалиновые батарейки — отличия
Щелочные батарейки также называются алкалиновыми. Название происходит от английского слова «alkaline», которое переводится как «щелочь» и определяет тип электролита в составе устройств питания. На оболочках батареек иностранного производства есть соответствующая надпись на английском языке.
Отличие щелочных батареек от солевых
Чем отличаются солевые и щелочные элементы питания:
Состав батарейки
Состав щелочных аккумуляторов идентичен с солевыми аналогами. Характеристики устройства повышаются за счет разницы в проводящем ток растворе и измененной конструкции.
Из каких химических компонентов состоят алкалиновые аккумуляторы:
Как устроен элемент питания
Составные части элементов питания на щелочной основе расположены в обратном порядке в сравнении с конструкцией солевых АКБ.
Компоненты алкалиновых батареек:
При нарушении условий эксплуатации концентрация газов в оболочке возрастает, конструкция разгерметизируется и электролит вытекает. Чтобы увеличить срок годности алкалиновых батареек, в раствор щелочи добавляются загустители, а порошок цинка дополнительно ингибируется против коррозии.
Классификация алкалиновых батареек
Маркировка щелочных аккумуляторов отличается у производителей из разных стран, поэтому устройства классифицируют по нескольким параметрам.
По внешней оболочке различаются:
Алкалиновые батарейки имеют на корпусе маркировку: L, LR, Alkaline Battery.
Характеристики щелочных элементов питания
Производители АКБ на основе щелочных растворов указывают следующие характеристики устройств:
Параметры напряжения и мощности необходимо учитывать при выборе батареек для работы с токами высоких разрядов. Наибольшая производительность отмечается при чередовании повышенных нагрузок и продолжительного бездействия устройств.
Где используются щелочные батарейки
Хорошая производительность и широкий выбор технических параметров сохраняют востребованность этих элементов у потребителей.
Какие приборы питаются от алкалиновых батареек:
Преимущества и недостатки батареек на щелочной основе
Щелочные аккумуляторы обладают следующими положительными сторонами:
Можно ли заряжать алкалиновые батарейки?
Перезаряжаемые алкалиновые устройства выпускаются не всеми производителями. На коробке и корпусе элементов есть отметка RAM (Rechargeable Alkaline Manganese Battery, т. е. перезаряжаемая щелочная марганцевая батарея).
Стоят полуторавольтовые аккумуляторные батареи дороже, но быстро окупаются. Важно отметить, что их емкость рассчитана на 20-25 подзарядок, затем устройство изнашивается и отправляется на утилизацию.
Обычные батарейки на щелочной основе являются одноразовыми и не предусматривают повторного использования. Восстановить емкость элемента способами, придуманными для солевых батареек, не получится, и применять их небезопасно.
Аналоги щелочных батареек и их цена
Наряду с элементами питания на основе щелочных растворов используются сухие (солевые угольно-цинковые или хлорид цинковые), ртутные, серебряные, литиевые источники энергии.
Отличительные черты этих устройств:
Полезные рекомендации
За 12 месяцев хранения щелочная батарейка теряет 10-15% заряда, поэтому рекомендуется использовать устройство сразу после покупки, не выбирать товары с истекающим сроком годности.
Забытые в слоте питания батарейки часто протекают из-за усиливающейся при саморазряде химической реакции. Это чревато порчей техники, поэтому из неиспользуемых пультов, игрушек или других приборов элементы лучше вынимать.
Не рекомендуется пытаться зарядить любые элементы питания, кроме аккумуляторных батарей, которые имеют соответствующую отметку. Для перезарядки используются специальные приборы, другие способы небезопасны и не гарантируют результата.
Утилизацией использованных батареек занимаются компании по переработке токсичных отходов. В крупных российских городах обязательно есть по несколько пунктов приема.
Выбрать форму, размер и емкость устройства поможет инструкция по эксплуатации техники. Выбор производителя остается за покупателем, однако на рынке востребованы товары мировых брендов (Philips, Toshiba, Sony, Duracell, Panasonic и др.).