что лучше фторурацил или капецитабин
Что лучше фторурацил или капецитабин

Заслуженный деятель науки РФ, главный научный сотрудник
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
председатель Российского общества клинической онкологии (RUSSCO),
профессор, доктор медицинских наук,
Москва
Метастатический рак желудка остается неприступной крепостью для современной лекарственной терапии. Стандартные комбинации, к коим относятся платиносодержащие CF (цисплатин и 5-фторурацил) или ECF (эпирубицин, цисплатин, длительные постоянные инфузии 5-фторурацила), способны продлить жизнь больных на срок 8-10 месяцев. Только у больных раком желудка с гиперэкспрессией HER-2, встречаемой у 10-15% пациентов, добавление трастузумаба позволило увеличить продолжительность жизни более года [1]. В последнее время были предприняты попытки улучшить результаты лечения за счет включения оксалиплатина вместо цисплатина, капецитабина вместо 5-фторурацила или добавления доцетаксела. Комбинации ECX (эпирубицин, цисплатина и капецитабина), EOX (эпирубицин, оксалиплатин и капецитабин), FOLFOX (оксалиплатин, лейковорин, 5-фторурацил струйно и инфузионно) продемонстрировали равную эффективность с СF или ECF, комбинация DCF (доцетаксел, цисплатин и 5-фторурацил инфузионно) была более эффективной, но и более токсичной по сравнению с CF 2. Несмотря на все усилия, продолжительность жизни больных метастатическим раком желудка не превышала 10 месяцев.
Другой причиной разработки новых комбинаций является плохая переносимость цисплатина больными раком желудка. Поэтому комбинации с включением оксалиплатина при равной эффективности, но лучшей переносимости постепенно вытесняют цисплатин-содержащие комбинации. Еще одним препаратом, продемонстрировавшим свою активность при раке желудка, является иринотекан. Иринотекан – препарат, который широко применяется для проведения второй линии химиотерапии рака желудка. В рандомизированном исследовании комбинация иринотекана и еженедельного введения 5-фторурацила продемонстрировала равную эффективность и меньшую токсичность по сравнению с СF в первой линии [5]. Однако эта комбинация с включением иринотекана так и не была признана стандартной для проведения первой линии.
В рандомизированном исследовании III фазы проведено сравнение комбинации ECX и популярной иринотекан-содержащей комбинации FOLFIRI, используемой в терапии колоректального рака, при проведении первой линии химиотерапии больным метастатическим раком желудка [6].
Основным критерием эффективности была медиана времени до неудачи лечения (time to treatment failure-TTF), которая определялась как интервал между рандомизацией и прогрессированием заболевания или отменой лечения или смертью пациента.
В течение 2005-2008 годов в исследование было включено 415 больных, средний возраст которых составил 61 год, 74% были мужчинами, у 84% был метастатический процесс, у 24% операция гастрэктомия в анамнезе и у 10% адъювантная химио- или химиолучевая терапия. При медиане наблюдения 31 мес. медиана TTF составила 5,1 мес. для FOLFIRI и 4,2 мес. для ECX (HR=0,77 p=0.008). Медиана времен до прогрессирования и частота объективного эффекта были 5,75 мес. и 38% у пациентов, получавших FOLFIRI, и 5,29 мес. и 39% у тех, кто получал ECX. Вторую линию химиотерапии получили 39% больных в группе FOLFIRI и 48% в группе ECX. Медиана общей продолжительности жизни составила 9,72 мес. и 9,49 мес. соответственно.
Частота побочных эффектов 3-4 степени была достоверно выше в группе ECX (84% и 69%), включая гематологическую (64,5% и 38%). Частота негематологических осложнений была одинаковой и составила 53% для FOLFIRI и 53,5% для ЕСХ, лечение было прекращено по причине токсичности у 3,9% и 14,5% больных соответственно. Авторы не приводят частоту тошноты и рвоты, характерного осложнения для цисплатина, и диареи, которая может наблюдаться при назначении обеих комбинаций.
Таким образом, данное исследование является хорошей новостью для наших больных метастатическим раком желудка. В нашем арсенале появился хорошо знакомый, умеренно токсичный и сравнимый по эффективности режим FOLFIRI. Плохая новость состоит в том, что, несмотря на применение самых лучших комбинаций в первой линии химиотерапии, большинство больных метастатическим раком желудка умирает в течение первого года после постановки диагноза.
Ключевые слова: рак желудка, первая линия химиотерапии, FOLFIRI, иринотекан.
Капецитабин и фторурацил в лечении колоректального рака и рака желудка: анализ прямых сравнительных исследований
Отделение клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН, Москва
В обзоре рассматривается место капецитабина как альтернативы фторурацилу (ФУ) в лечении колоректального рака (КРР) и рака желудка (РЖ). На основании результатов проведенных рандомизированных клинических исследований делается вывод, что у больных КРР-режимы с капецитабином равноэффективны таковым на основе инфузионного ФУ по показателям общей выживаемости. В то же время при метастатическом РЖ капецитабин, вероятнее всего, является даже более эффективной альтернативой ФУ.
На протяжении 40 лет фторурацил (5-ФУ) был единственным препаратом, демонстрирующим эффективность в лечении метастатических гастроинтестинальных карцином. Объективный ответ в монотерапии составлял 12 %, а медиана общей выживаемости (ОВ) – 11 месяцев [2]. Применение комбинации 5-ФУ с лейковорином увеличивает уровень объективного ответа до 21 % против 11 % в группе без лейковорина (кальция фолината) [3].
Короткое время полужизни 5-ФУ привело исследователей к мысли об использовании пролонгированных инфузий препарата. Поскольку 5-ФУ действует только на клетки, находящиеся в S-фазе клеточного цикла, предполагали, что при его более длительном воздействии на опухоль большее число опухолевых клеток будет чувствительным к препарату. С другой стороны, длительные инфузии сопряжены с более низкими пиковыми концентрациями препарата в плазме крови и площадью под кривой концентрации, чем при болюсном введении. Это позволяет снижать токсичность лечения [1, 4].
Мета-анализ данных 6 рандомизированных исследований показал, что длительные инфузии 5-ФУ по сравнению с болюсным введением препарата ассоциировались с более высоким уровнем объективного ответа (22 против 14 %; р = 0,0002) и статистически значимым увеличением ОВ (12,1 и 11,3 месяца соответственно; р = 0,04) [5]. Кроме того, изменился и токсический профиль – снизилась частота развития миелотоксических реакций (4 против 31 %), но увеличивалась частота кожной токсичности (ладонно-подошвенный синдром (ЛПС) – 34 против 13 %).
Длительные инфузии 5-ФУ требуют постоянного венозного доступа в виде центрального венозного катетера или подкожно имплантированного порта. Кроме того, необходимо использование помп или инфузоматов. Все это приводит к существенному удорожанию лечения. Поэтому следующим этапом на пути оптимизации лечения 5-ФУ стало создание пероральных форм фторпиримидинов.
Интересно, что первое исследование по применению пероральной формы 5-ФУ провалилось [1]. Фармакокинетическое исследование продемонстрировало непредсказуемость абсорбции препарата в желудочно-кишечном тракте в связи с вариабельностью активности дигидропиримидин дегидрогиназы (ДПД) – фермента, расщепляющего 5-ФУ, в эпителии тонкой кишки [6]. Для преодоления проблемы используются следующие подходы: применение пролекарств (в таком случае образование активного метаболита происходит только после абсорбции препарата в кишке) либо использование препарата, содержащего 5-ФУ и вещества, снижающего активность ДПД. На сегодняшний день в мире используются четыре пероральных фторпиримидина: фторафур, УФТ (тегафур/урацил), препарат S-1 и капецитабин. Фторафур был некогда популярен в СССР, а UFT и S-1 применяются главным образом в азиатских странах и не зарегистрированы в России. Наибольшее распространение в мире получил капецитабин, что обусловлено широкой доказательной базой его эффективности, основанной на большом числе рандомизированных исследований.
К началу XXI в. в терапию гастроинтестинальных опухолей уже прочно вошли различные комбинации, основанные на струйных или инфузионных режимах применения 5-ФУ. Данный обзор посвящен анализу места капецитабина в лечении колоректального рака (КРР) и рака желудка (РЖ).
Капецитабин – 5-дезокси-5-фторN-[(пентилокси)карбонил]-цитидин (Кселода®; F. Hoffmann-La Roche, Швейцария). Капецитабин является пролекарственной формой 5-ФУ. В активный препарат капецитабин превращается в три этапа под действием ферментов (карбоксилэстераза и цитидиндеаминаза в печени, тимидинфосфорилаза (ТФ) в опухолевых клетках). Активность ТФ в опухоли в несколько раз выше, чем в нормальных тканях. Это и определяет в среднем трехкратное превышение концентрации 5-ФУ в опухоли по сравнению с другими тканями [1] и как следствие – большую эффективность и меньшую токсичность капецитабина по сравнению с внутривенным 5-ФУ.
Таблетки vs капельницы: что лучше?
В России у 3 762 218 человек диагностированы злокачественные новообразования и каждый год эта цифра увеличивается более чем на 600 000 новых случаев [1]. Всем онкопациентам необходимо противоопухолевое лечение, и многим из них – лекарственное.
Большую часть лекарственного противоопухолевого лечения пациенты, как правило, получают с помощью внутривенных инъекций. Это предполагает регулярное посещение онкологического учреждения для проведения очередного цикла терапии. Нередко это приносит неудобства, а инъекции могут быть болезненными. В некоторых случаях количество циклов не ограничено определенным числом, лечение может длиться месяцы или годы, вплоть до прогрессирования или развития непереносимой токсичности [2].
Чтобы пациент мог сократить количество визитов в больницу, все больше новых препаратов производится в пероральной форме.
Что такое пероральная лекарственная противоопухолевая терапия?
Безусловно такое лечение позволяет человеку вести активную жизнь и работать, что особенно актуально при длительной противоопухолевой терапии.
Таблетки – это только химиотерапия?
Не только. Ниже представлены основные препараты, которые можно использовать внутрь перорально:
Почему мне выписали таблетки, а моей знакомой с таким же диагнозом — капельницы?
Если вам назначили таблетки — это не значит, что исчерпаны все возможности вашего лечения.
Таблетки или капсулы могут назначаться как самостоятельное лечение, так и в качестве послеоперационного (после радикального удаления опухоли) профилактического (адъювантного) лечения. Пример таблетированной адъювантной терапии при раке молочной железы – тамоксифен или анастрозол в течение 5 лет [3].
В каких случаях могут назначить «химию» в таблетках?
Таблетки или капсулы назначают по определенным показаниям:
Таблетки также могут применяться в следующих случаях:
Например, пациенту может быть назначена поддерживающая лечебная химиотерапия капецитабином вместо внутривенного 5-фторурацила с лейковорином [4].
При опухолях каких органов могут назначить таблетки?
Рак молочной железы [5]:
Рак ободочной и прямой кишки [6,7]:
Рак яичников [8]:
Рак тела матки (метастатический процесс) [9]: гормонотерапия (летрозол, анастрозол, тамоксифен).
Рак шейки матки (метастатический процесс) [10]: капецитабин.
Немелкоклеточный рак легкого (метастатический процесс) [11]: Гефитиниб, Эрлотиниб, Афатиниб, Осимертиниб, Кризотиниб.
Почечно-клеточный рак (метастатический процесс) [12]: Сорафениб, Сунитиниб, Пазопаниб и Акситиниб.
Меланома кожи (послеоперационно или при метастатическом процессе) [13]: Дабрафениб, Траметиниб, Вемурафениб, Кобиметиниб.
Меньше ли осложнений от таблеток или капсул?
Нет, таблетки и капсулы — это все равно противоопухолевая терапия. Она отличается лишь способом доставки лекарственного средства в организм. Осложнения и побочные эффекты такие же, как и при инъекциях.
Потеряю ли я волосы от противоопухолевой лекарственной терапии в таблетках?
Да, в некоторых случая это возможно [14], например:
Будет ли тошнота и рвота при пероральной противоопухолевой лекарственной терапии?
Да, некоторые препараты больше других вызывают рвоту [15]:
Что делать в случае пропуска приема таблетки(-ок)?
* За исключением некоторых случаев. Необходимо ознакомиться с инструкцией к препарату.
Как не забыть принять противоопухолевые лекарства?
Что делать, если выпил двойную (и более) дозу?
Мне дали пачку таблеток – я могу просто пить таблетки и больше ничего не делать?
Нет, при каждом из препаратов требуется периодически выполнять обследования с целью выявления возможных осложнений лечения. Примеры:
Заключение
Что лучше фторурацил или капецитабин
Отделение клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН, Москва
На протяжении 40 лет фторурацил (5-ФУ) был единственным препаратом, демонстрирующим эффективность в лечении метастатических гастроинтестинальных карцином. Объективный ответ в монотерапии составлял 12 %, а медиана общей выживаемости (ОВ) – 11 месяцев [2]. Применение комбинации 5-ФУ с лейковорином увеличивает уровень объективного ответа до 21 % против 11 % в группе без лейковорина (кальция фолината) [3].
Короткое время полужизни 5-ФУ привело исследователей к мысли об использовании пролонгированных инфузий препарата. Поскольку 5-ФУ действует только на клетки, находящиеся в S-фазе клеточного цикла, предполагали, что при его более длительном воздействии на опухоль большее число опухолевых клеток будет чувствительным к препарату. С другой стороны, длительные инфузии сопряжены с более низкими пиковыми концентрациями препарата в плазме крови и площадью под кривой концентрации, чем при болюсном введении. Это позволяет снижать токсичность лечения [1, 4].
Мета-анализ данных 6 рандомизированных исследований показал, что длительные инфузии 5-ФУ по сравнению с болюсным введением препарата ассоциировались с более высоким уровнем объективного ответа (22 против 14 %; р = 0,0002) и статистически значимым увеличением ОВ (12,1 и 11,3 месяца соответственно; р = 0,04) [5]. Кроме того, изменился и токсический профиль – снизилась частота развития миелотоксических реакций (4 против 31 %), но увеличивалась частота кожной токсичности (ладонно-подошвенный синдром (ЛПС) – 34 против 13 %).
Длительные инфузии 5-ФУ требуют постоянного венозного доступа в виде центрального венозного катетера или подкожно имплантированного порта. Кроме того, необходимо использование помп или инфузоматов. Все это приводит к существенному удорожанию лечения. Поэтому следующим этапом на пути оптимизации лечения 5-ФУ стало создание пероральных форм фторпиримидинов.
Интересно, что первое исследование по применению пероральной формы 5-ФУ провалилось [1]. Фармакокинетическое исследование продемонстрировало непредсказуемость абсорбции препарата в желудочно-кишечном тракте в связи с вариабельностью активности дигидропиримидин дегидрогиназы (ДПД) – фермента, расщепляющего 5-ФУ, в эпителии тонкой кишки [6]. Для преодоления проблемы используются следующие подходы: применение пролекарств (в таком случае образование активного метаболита происходит только после абсорбции препарата в кишке) либо использование препарата, содержащего 5-ФУ и вещества, снижающего активность ДПД. На сегодняшний день в мире используются четыре пероральных фторпиримидина: фторафур, УФТ (тегафур/урацил), препарат S-1 и капецитабин. Фторафур был некогда популярен в СССР, а UFT и S-1 применяются главным образом в азиатских странах и не зарегистрированы в России. Наибольшее распространение в мире получил капецитабин, что обусловлено широкой доказательной базой его эффективности, основанной на большом числе рандомизированных исследований.
К началу XXI в. в терапию гастроинтестинальных опухолей уже прочно вошли различные комбинации, основанные на струйных или инфузионных режимах применения 5-ФУ. Данный обзор посвящен анализу места капецитабина в лечении колоректального рака (КРР) и рака желудка (РЖ).
Капецитабин – 5-дезокси-5-фторN-[(пентилокси)карбонил]-цитидин (Кселода®; F. Hoffmann-La Roche, Швейцария). Капецитабин является пролекарственной формой 5-ФУ. В активный препарат капецитабин превращается в три этапа под действием ферментов (карбоксилэстераза и цитидиндеаминаза в печени, тимидинфосфорилаза (ТФ) в опухолевых клетках). Активность ТФ в опухоли в несколько раз выше, чем в нормальных тканях. Это и определяет в среднем трехкратное превышение концентрации 5-ФУ в опухоли по сравнению с другими тканями [1] и как следствие – большую эффективность и меньшую токсичность капецитабина по сравнению с внутривенным 5-ФУ.
Колоректальный рак
Капецитабин и струйное введения 5-ФУ
Сравнение капецитабина с болюсным применением 5-ФУ с лейковорином было проведено в двух исследованиях III фазы [9, 10]. Хотя медиана ВДП и ОВ в группах не различались, объективный ответ был статистически значимо выше в группе больных, принимавших капецитабин (24,8 против 15,5 %; р = 0,005). При этом удалось значительно снизить выраженность побочных эффектов, особенно стоматита и нейтропении 3–4 степени. Реже при применении капецитабина было и число госпитализаций в связи с непереносимой токсичностью. Выросла лишь частота ЛПС.
Известны результаты применения капецитабина в адъювантной терапии у больных III стадей КРР. В исследовании X-ACT больные были рандомизированы в две группы: в первой группе проводилать терапия капецитабином 2500 мг/м2/сут 1–14-й дни, пациенты второй группы получали болюсно 5-ФУ с лейковорином (схема клиники Мейо) [16]. При медиане наблюдения 3,8 года показатели выживаемости без признаков болезни не различались (5-летняя выживаемость без признаков болезни составила: 63,2 и 60,8 % соответственно; р = 0,12). Однако отмечена тенденция к повышению общей выживаемости в группе капецитабина (5-летняя выживаемость 71,4 и 68,4 % соответственно; р = 0,06). На основании этих данных можно сделать вывод, что капецитабин не уступает по эффективности и лучше переносится, чем струйные режимы введения 5-ФУ.
Сравнение капецитабина и инфузионных режимов введения 5-ФУ
Лучшая переносимость длительных инфузий 5-ФУ при схожей эффективности по сравнению со струйными режимами стала в последние годы приводить к постепенному вытеснению последних из клинической практики. Прямого сравнения эффективности и токсичности капецитабина с инфузиями 5-ФУ не проводилось. Об этом можно лишь косвенно судить при сопоставлении и сравнении переносимости схем с использованием капецитабина или 5-ФУ и других химиотерапевтических препаратов (оксалиплатин и иринотекан).
Эквивалентность эффективности капецитабина и 5-ФУ при опухолях ЖКТ была оценена в пяти рандомизированных исследованиях III фазы.
В 2007 г. было опубликовано рандомизированное исследование по сравнению режимов FUFOX (инфузия 5-ФУ 2000 мг/м2 в/в 22 часа и оксалиплатин 50 мг/м2 в/в в 1-й, 8-й, 15-й и 22-й день, каждые 36 дней) и CAPOX (оксалиплатин 70 мг/м2 внутривенно 1-й, 8-й день каждые 22 дня и капецитабин 2000 мг/м2 внутрь в сутки 1–14-й дни) в 1-й линии терапии пациентов с метастатическим КРР. Рандомизировано 338 больных. Время до прогрессирования (7,1 против 8,0 месяцев; р = 0,117), общая выживаемость (16,8 против 18,8 месяца; р = 0,26) не различались и была отмечена тенденция к преимуществу инфузионной схемы [14].
В 2000 г. представлены были результаты сравнения эффективности схем с оксалиплатином в 1-й (NO16966) [17] и 2-й линиях (NO16967) [18] терапии пациентов с метастатическим КРР: XELOX (капецитабин + оксалиплатин) и FOLFOX (оксалиплатин + лейковорин + инфузии 5-ФУ). В первом исследовании дизайн был изменен на 2 : 2 в связи с дальнейшим добавлением бевацизумаба/плацебо к химиотерапии на основе оксалиплатина [19]. При этом дозу капецитабина уменьшили с 2000 до 1700 мг/м2/ сут. В первом исследовании лечение получили 147 пациентов, во втором – 213. В целом не было отмечено существенных различий в эффективности режимов с капецитабином и инфузиями 5-ФУ.
ОВ в исследовании TREE-1 составила 19,2, 17,9 и 17,2 месяца соответственно в группах с инфузией 5-ФУ, его болюсным введением и в группе капецитабина (различия статистически не значимы). При добавлении бевацизумаба ОВ составила – 26,1, 20,4 и 24,6 месяца соответственно.
Другим активным препаратом в лечении КРР является иринотекан, применяемый как в монотерапии, так и в комбинированных режимах с 5-ФУ. Еще несколько лет назад в США чаще использовался режим со струйным применением 5-ФУ (IFL), тогда как в Европе набирала популярность комбинация FOLFIRI (иринотекан + лейковарин + 5-ФУ). Настало время проведения прямого сравнения данных режимов, а также комбинации с капецитабином (CapeIRI). В 2007 г. на ASCO были представлены результаты американского рандомизированного исследования BICC-С, в котором применялись все указанные режимы [11]. Лечение в последней группе было досрочно прекращено по причине неприемлемой токсичности. Отметим, что применение режима CapeIRI было ассоциировано с более высокой частотой диареи. Медиана ВДП при сравнении FOLFIRI, IFL и CapeIRI составила 7,6, 5,9 и 5,8 месяца (р = 0,004), ОВ – 23,1, 18,9 и 17,6 месяцев соответственно (р = 0,09). Исследование подтвердило большую эффективность инфузионной схемы над болюсной. Более высокую токсичность режима CapeIRI, по-видимому, можно объяснить применением высоких доз препаратов (иринотекан 250 мг/м2 1 раз в 3 недели и капецитабин 2000 мг/м2 в сутки 1–14-й дни). Рандомизированное исследование II фазы по сравнению режимов FOLFIRI и XELIRI в тех же дозах показало одинаковую частоту диареи при применении обеих схем (3–4-я степени – 6 %) [28].
Результаты ключевых исследований III фазы по сравнению эффективности капецитабина и инфузий 5-ФУ в схемах с оксалиплатином и иринотеканом больным метастатическим КРР представлены в табл. 1
Таблица 1. Результаты исследований по сравнению эффективности капецитабина и инфузий 5-ФУ в сочетании соксалиплатином и иринотеканом у больных метастатическим КРР.
Токсичность и переносимость
В исследовании MO66001 (сравнение адъювантных режимов: капецитабин против болюсного введения лейковорина и 5-ФУ) развитие токсических реакций 3–4-й степени в процессе терапии капецитабином было достоверно более редким, чем в группе с 5-ФУ. Из табл. 2 следует, что для капецитабина характерно такое осложнение, как ЛПС. В то же время нейтропения, диарея, тошнота/рвота, стоматит и алопеция развивались значительно реже. Отметим, что при сравнении качества жизни в процессе терапии и после ее завершения различий между группами обнаружено не было [16].
Таблица 2. Сравнение токсичности в исследованиях химиотерапии на основе капецитабина и 5-ФУ у больных КРР, %.
По данным исследования NO16966, общая частота токсических реакций 3–4-й степеней была одинаковой в группах с капецитабином и 5-ФУ. Однако 4-я степень токсических реакций чаще наблюдалась в группе с FOLFOX (22 против 11 %). В первую очередь это различие было обусловлено нейтропенией 4-й степени. Частота нейтропении 3–4-й степеней в группе FOLFOX составила 44 против 7 % в группе с капецитабином, венозные тромбоэмболические события также были ассоциированы с режимом FOLFOX (6,3 против 3,8 %). Среди побочных явлений 3-й степени у пациентов, получавших XELOX, чаще, чем в группе FOLFOX, встречались диарея (19 против 11 %), ЛПС (6 против 1 %) [17].
В исследовании NO16967 (2-я линия терапии) побочные явления 3–4-й степени чаще наблюдались при режиме с инфузией 5-ФУ (65 против 50 %); эти различия, как и в исследовании NO16966, были обусловлены в основном нейтропенией. В отличие от применения капецитабина в адъювантном режиме и в составе схем 1-й линии у пациентов, получавших режим XELOX во 2-й линии, чаще наблюдались побочные явления 3–4-й степеней со стороны желудочно-кишечного тракта (33 против 20 %). Так, диарея 3–4-й степеней была отмечена у 19 % больных в сравнении с 5 % пациентов, получавших FOLFOX. Применение капецитабина не увеличивало частоту периферических сенсорных невропатий на фоне применения оксалиплатина ни в 1-й, ни во 2-й линиях химиотерапии (табл. 2) [18].
Рак желудка
В отличие от метастатического КРР, при котором эффективность химиотерапии была показана достаточно давно, среди многих специалистов до последнего времени оставался скептицизм по поводу необходимости проведения лекарственной терапии при метастатическом РЖ. В мета-анализе было продемонстрировано достоверное увеличение продолжительности жизни при назначении химиотерапии по сравнению с симптоматической терапией (отношение рисков [ОР] – 0,39; 95 % доверительный интервал [ДИ] – 0,28–0,52), а также преимущество комбинированной терапии перед монотерапией (ОР – 0,83; 95 % ДИ – 0,74–0,93) [29]. Основой терапии РЖ стали цисплатин и 5-ФУ. Их комбинация с применением 5-суточной инфузии 5-ФУ (режим PF) стала стандартом лечения в США и некоторых странах Западной Европы. В то же время в Великобритании использовалась другая комбинация: эпирубицина, цисплатина и непрерывной инфузии 5-ФУ (ECF), показавшая свое превосходство над некогда популярным бесплатиновым режимом FAMTX (медиана ОВ – 8,9 и 5,7 месяца соответственно; р = 0,0009) [30]. Успешный опыт применения капецитабина при КРР естественным образом подвел к необходимости проведения сравнительных исследований эффективности 5-ФУ и капецитабина при распространенном раке желудка.
Эффективность 5-ФУ и капецитабина
В крупном рандомизированном исследовании REAL-2, с включением 964 больных с метастатической аденокарценомой желудка и нижней трети пищевода кроме сравнения двух фторпиримидинов изучалась и возможность замены цисплатина на оксалиплатин [31]. В качестве основного режима был избран уже ставший стандартным ECF (эпирубицин, цисплатин, болюсно 5-ФУ), а в трех других экспериментальных группах последовательно заменялись цисплатин на оксалиплатин, а 5-ФУ – на капецитабин режимы EOX (эпирубицин, оксалиплатин, капецитабин), EOF (эпирубицин, оксалиплатин, болюсно 5-ФУ) и ECX (эпирубицин, цисплатин, капецитабин). Предполагалось, что данное исследование позволит продемонстрировать эффективность новых режимов терапии, не уступающую стандартному ECF по показателям выживаемости (noninferiority дизайн).
В группе EOX отмечена достоверно более высокая продолжительность жизни, тогда как в трех других группах результаты оказались схожими (табл. 3). Дальнейший анализ выявил увеличение выживаемости без прогрессии при режимах, в которых капецитабин использовался вместо 5-ФУ (ОР – 0,85; 95 % ДИ – 0,64–1,13), тогда как при сравнении цисплатина с оксалиплатином наблюдалась лишь тенденция к улучшению результатов в пользу последнего (ОР – 0,92; 95 % ДИ – 0,80–1,10).
Таблица 3. Результаты рандомизированных исследований по сравнению капецитабина с 5-ФУ при метастатическом РЖ.
В другом исследовании III фазы, ML17032 больные с распространеным раком желудка (316 пациентов) были рандомизированы в две группы, получавшие лечение по схемам FP и XР в качестве первой линии терапии [32]. Как и в предыдущем исследовании, основной задачей было продемонстрировать не меньшую эффективность режима с капецитабином, что и было сделано. Медиана выживаемости без прогрессии в группах FP и XP составили 5,0 и 5,6 месяца (ОР – 0,81; 95 % ДИ – 0,63–1,04; p > 0,001), а ОВ – 9,3 и 10,5 месяца (ОР – 0,85; 95 % ДИ – 0,64–1,13; p = 0,008) соответственно. Частота объективного ответа оказалась достоверно выше в группе капецитабина и составила 46 % в сравненн с 32 % в группе 5-ФУ.
Таким образом, в обоих исследованиях было четко показано, что режимы с капецитабином по эффективности не уступают комбинациям с 5-ФУ. При этом было отмечено преимущество режимов с капецитабином. Поскольку статистическая сила каждого из исследований не позволяла достоверно подтвердить это превосходство, было решено провести совместный анализ результатов двух этих работ [33]. С увеличением числа пациентов удалось зарегистрировать достоверное увеличение ОВ в режимах с капецитабином (10,7 месяца) по сравнению с группами, получавшими 5-ФУ (9,5 месяца; ОР – 0,87; 95 % ДИ – 0,77–0,98; p = 0,027). Эти различия остались достоверными и по результатам проведенного многофакторного анализа. Преимущества от добавления капецитабина не завило от возраста и общего состояния больных. Кроме того, для режимов с капецитабином отмечена тенденция к увеличению ВДП (6,6 против 6,0 мес; ОР – 0,91; 95 % ДИ – 0,81–1,02; р = 0,093) и достоверному повышению частоты объективного ответа (45,6 против 38,4 %; р = 0,006).
Токсичность и переносимость
В исследовании REAL-2 токсический профиль всех четырех комбинаций был схожим, и различия не носили принципиального характера. Однако нейтропения 3–4-й степени чаще встречалась в группе ECX (51 %) и достоверно реже – в EOF (30 %) и EOX (28 %). В то же время в двух последних группах чаще развивались диарея 3–4-й степеней (11–12 %), что, вероятнее всего, обусловлено использованием оксалиплатина вместо цисплатина. Частым осложнением терапии капецитабином является ЛПС, который в 10 % случаев был зафиксирован в группе ECX (3–4 степени), тогда как в остальных трех группах его частота не превышала 4 %.
В исследовании ML17032 токсичность обоих режимов была ниже, что, по-видимому, было обусловлено отсутствием эпирубицина. Замена инфузий 5-ФУ на капецитабин не привела к росту частоты и выраженности каких-либо осложнений, за исключением ЛПС (3-й степени – 4 %).
Фармакоэкономический анализ
С учетом схожих эффективности и токсичности капецитабина и инфузионного 5-ФУ большое значение приобретает такой параметр, как стоимость лечения. С одной стороны, сам капецитабин существенно дороже, чем 5-ФУ. С другой стороны, при использовании перорального приема препарата нет необходимости в частых посещениях клиники, применения центральных катетеров, венозных портов и инфузионных помп. Фармакоэкономический анализ, смоделированный по данным исследований REAL-2 и ML17032, учитывающий дополнительные затраты, возникающие при использовании 5-ФУ, показал, что в итоге терапия с капецитабином требует меньших денежных затрат. несмотря на более высокую стоимость препарата (табл. 4) [34].
Таблица 4. Сравнительная стоимость терапии различными режимами с включением цисплатина, капецитабина или 5-ФУ при метастатическом РЖ (фунты стерлингов) [34].
Мета-анализ данных рандомизированных исследований III фазы при РЖ и КРР
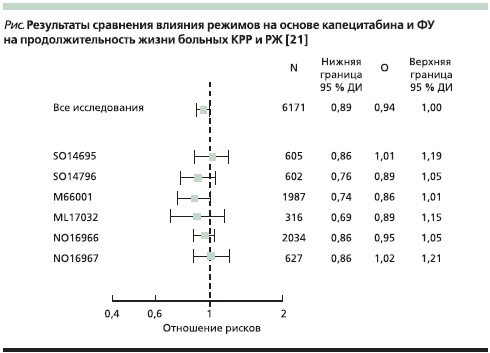
Следует отметить, что в ряде рассмотренных выше работ статистическая гипотеза не была рассчитана на то, чтобы доказать эквивалентность режимов в отношении показателей общей выживаемости. Принимая это во внимание, в 2011 г. были представлены результаты мета-анализа шести исследований, цель которого была доказать эквивалентность режимов с капецитабином режимам с 5-ФУ в плане достижения одинаковых показателей общей выживаемости [21]. В данный мета-анализ были включены данные по 6171 пациенту: с III стадией КРР – 1987 больных; 3868 больных с метастатическим КРР (исследование SO14695, SO14796, NO16966, NO16967), с распространенным РЖ – 316 пациентов (исследование ML17032). Из их числа 3097 больным проведена терапия на основе капецитабина, 3074 – на основе 5-ФУ с лейковорином. Анализ выполнялся для всей группы пациентов и отдельно в зависимости от локализации и распространенности опухолевого процесса. Результаты проведенного мета-анализа демонстрируют статически значимую эквивалентность схем на основе капецитабина режимам на основе 5-ФУ в отношении ОВ (ОР – 0,94, 95 % ДИ – 0,89–1,00; P = 0,0489). Учитывая факт, что 95 %, включенных в анализ имели рак толстой кишки, полученные данные в большей степени распространяются на данную нозологию (см. рисунок).
Помимо этого опубликованы данные двух мета-анализов, целью проведения которых являлось доказательство эквивалентности капецитабина и 5-ФУ преимущественно среди больных КРР. Cassidy и соавт. объединили данные 7 исследований II и III фаз (2826 пациентов), в которых проводилось сравнение режимов капецитабин +оксалиплатин и 5-ФУ/лейковорин + оксалиплатин для больных метастатическим КРР. Авторы показали, что ОР в отношении общей выживаемости составил 1,02 (95 % ДИ – 0,95–1,12) [24]. Второй мета-анализ был выполнен Arkenau и соавт.; в нем были получены аналогичные результаты по данных 6 рандомизированных исследований (3494 больных): ОР – 1,04 (95% ДИ – 0,95–1,12) [25].
Заключение
Основываясь на анализе результатов многочисленных рандомизированных исследований, можно утверждать, что для больных КРР режимы с капецитабином равноэффективны таковым на основе инфузионного ФУ по показателям общей выживаемости. В то же время при метастатическом РЖ капецитабин, вероятнее всего, является даже более эффективной альтернативой ФУ.
Однако при схожей эффективности эти фторпиримидины все же имеют определенные различия. Капецитабин необходимо с осторожностью применять при нарушении функции почек, а отдельных больных с выраженной диареей или ЛПС приходится переводить на режимы с инфузиями 5-ФУ.
Все это нисколько не умаляет значение капецитабина, а лишь дает возможность врачу и пациенту выбрать оптимальный режим терапии.
Информация об авторах:
Федянин Михаил Юрьевич – кандидат медицинских наук, врач-онколог отделения клинической
фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина.
E-mail: fedianinmu@mail.ru;
Трякин Алексей Александрович – кандидат медицинских наук, старший научный сотрудник
отделения клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина
Литература
1. Schellens JHM. Cancer clinical pharmacology. Oxford Univercity Press 2006:52.
2. Meta-analysis Group In Cancer. Efficacy of intravenous continuous infusion of fluorouracil compared with bolus administration in advanced colorectal cancer. J Clin Oncol 1998; 16:301–08.
3. Thirion P, Michiels S, Pignon JP, et al. Modulation of fluorouracil by leucovorin in patients with advanced colorectal cancer: an updated metaanalysis. J Clin Oncol 2004;22:3766–75.
4. de Gramont A, Bosset JF, Milan C, et al. Randomized trial comparing monthly lowdose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer: a French intergroup study. J Clin Oncol 1997;15:808–15.
5. Maughan TS, James R.D, Kerr DJ, et al. Preliminary results of multicenter randomized trail comparing 3 chemotherapy regimens (de Gramont, Lokich, and Raltitrexed) in metastatic colorectal cancer. Proc Am Soc Clin Oncol 1999;18:262a.
6. Pentheroudakis G, Twelves C. The rational development of capecitabine from the laboratory to the clinic. Anticancer Res 2002; 22:3589–96.
7. Budman DR, Meropol NJ, Reigner B, et al. Preliminary studies of novel oral fluoropyrimidine carbamate: capecitabine. J Clin Oncol 1998;16:1795–802.
8. Van Cutsem E, Findlay M, Osterwalder B, et al. Capecitabine, an oral fluoropyrimidine carbamate with substantial activity in advanced colorectal cancer: results of a randomized phase II study. J Clin Oncol 2000;18:1337–45.
9. Van Cutsem E, Twelves C, Cassidy J, et al. Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 2001; 19:4097–106.
10. Hoff PM, Ansari R, Batist G, et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 2001;19:2282–92.
11. Fuchs CS, Marshall J, Mitchell E, et al. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C study. J Clin Oncol 2007;30:4779–86.
12. Hochster HS, Hart LL, Ramanathan RK, et al. Safety and efficacy of oxaliplatin and fluoropyrimidine regimens with or without bevacizumab as first-line treatment of metastatic colorectal cancer: results of the TREE study. J Clin Oncol 2008;26(21):3523–29.
13. Ducreux M, Bennouna J, Hebbar M, et al. Efficacy and safety findings from a randomized phase III study of capecitabine (X) + oxaliplatin (O) (XELOX) vs infusional 5-FU/LV + O (FOLFOX-6) for metastatic colorectal cancer (MCRC). J Clin Oncol 2007;25:4029.
14. Porschen R, Arkenau HT, Kubicka S, et al. Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 2007;25:4217–23.
15. Diaz-Rubio E, Tabernero J, Gomez-Espan A, et al. Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-Line therapy in metastatic colorectal cancer: final report of the spanish cooperative group for the treatment of digestive tumors trial. J Clin Oncol 2007; 25(27):4224–30.
16. Twelves C, Wong A, Nowacki MP, et al. Capecitabine as adjuvant treatment for stage III colon cancer. ECCO 2007(Abst IBL).
17. Cassidy J, Clarke S, Diaz Rubio E, et al. A randomized phase III study of capecitabine plus oxaliplatin (XELOX) versus fluorouracil/folinic acid plus oxaliplatin (FOLFOX-4) as first-line therapy for metastatic colorectal cancer. J Clin Oncol 2008;26:2006–12.
18. Rothenberg ML, Cox JV, Butts C, et al. Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/folinic acid plus oxaliplatin (FOLFOX-4) as second-line therapy in metastatic colorectal cancer: a randomized phase III noninferiority study. Ann Oncol 2008;19:1720–26.
19. Saltz L, Clarke S, Diaz-Rubio E. et al. Efficacy and safety of bevacizumab in combination with oxaliplatin-based chemotherapy as firstline therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008;26:2013–19.
20. Kang YK, Kang WK, Shin DB, et al. Capecitabinecisplatin versus 5-fluorouracil/cisplatin as firstline therapy in patients with advanced gastric cancer: a randomized phase III noninferiority trial. Ann Oncol 2009;20:666–73.
21. Cassidy J, Saltz L, Twelves C, et al. Efficacy of capecitabine versus 5-fluorouracil in colorectal and gastric cancers: a meta-analysis of individual data from 6171 patients. Ann Oncol 2011 Mar 17. [Epub ahead of print].
22. Cunningham D, Starling N, Rao S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med 2008;358:36–46.
23. Okines AF, Norman AR, McCloud P, et al. Metaanalysis of the REAL-2 and ML17032 trials: evaluating capecitabine-based combination chemotherapy and infused 5-fluorouracil-based combination chemotherapy for the treatment of advanced oesophago-gastric cancer. Ann Oncol 2009;20:1529–34.
24. Cassidy J, Clarke S, Diaz-Rubio E, et al. XELOX vs. FOLFOX4: update of efficacy results from XELOX-1/NO16966, a randomized phase III trial of first-line treatment for patients (pts) with metastatic colorectal cancer (MCRC). Presented at the ASCO GI Cancers Symposium, 25–27 January, 2008;341.
25. Arkenau HT, Arnold D, Cassidy J, et al. Efficacy of oxaliplatin plus capecitabine or infusional fluorouracil/leucovorin in patients with metastatic colorectal cancer: a pooled analysis of randomized trials. J Clin Oncol 2008; 26:5910–17.
26. Saltz LB, Clarke S, Diaz-Rubio E, et al. Bevacizumab in combination with oxaliplatinbased chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26:2013–19.
27. Baek JH, Kim JG, Jeon SB, et al. Phase II study of capecitabine and irinotecan combination chemotherapy in patients with advanced gastric cancer. Br J Cancer 2006;94(10):1407–11.
28. Skof E, Rebersek M, Hlebanja Z, et al. Capecitabine plus Irinotecan (XELIRI regimen) compared to 5-FU/LV plus Irinotecan (FOLFIRI regimen) as neoadjuvant treatment for patients with unresectable liver-only metastases of metastatic colorectal cancer: a randomised prospective phase II trial. BMC Cancer 2009;9:120.
29. Wagner AD, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol 2006; 24:2903–09.
30. Webb A, Cunningham D, Scarffe JH, et al. Randomized trial comparing epirubicin, cisplatin, and fluorouracil versus fluorouracil, doxorubicin, and methotrexate in advanced esophagogastric cancer. J Clin Oncol 1997; 15(1):261–67.
31. Cunningham D, Starling N, Rao S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med 2008;358:36–46.
32. Kang YK, Kang WK, Shin DB, et al. Capecitabine/ cisplatin versus 5-fluorouracil/cisplatin as firstline therapy in patients with advanced gastric cancer: a randomised phase III noninferiority trial. Ann Oncol 2009;20(4):666–73.
33. Norman G, Soares M, Peura P, et al. Capecitabine for the treatment of advanced gastric cancer. Health Technol Assess. 2010; 14(2):11–7.
34. Okines AFC, Norman AR, McCloud P, et al. Metaanalysis of the REAL-2 and ML17032 trials: evaluating capecitabine-based combination chemotherapy and infused 5-fluorouracil-based combination chemotherapy for the treatment of advanced oesophago-gastric cancer. Ann Oncol 2009;20:1529–34.