Молекулярные машины в живой клетке
Нанороботы внутри нас: как работают клетки
По подсчетам биологов, в живой клетке функционирует около сорока известных науке молекулярных машин. Они возят грузы по молекулярным «рельсам», выступают в качестве «включателей» и «выключателей» химических процессов. Машины из молекул производят энергию для поддержания жизни, сокращают наши мышцы и строят другие молекулярные машины. А еще они вдохновляют ученых на строительство рукотворных нанороботов, которые в будущем смогут жить и работать во внутриклеточном мире.
Чтобы представить себе, из чего и как ученые-гулливеры будут строить роботов-лилипутов, мы рассмотрели несколько наномашин, созданных самой природой.
Жгутик бактерии
Александр Марков, биолог, популяризатор науки, профессор МГУ: «В ходе эволюции очень легко возникают системы, выглядящие на первый взгляд «несократимо сложными». Они состоят из многих частей, которые приносят пользу только все вместе, убери одну — и вся система перестает работать, а каждая отдельная часть сама по себе вроде бы бесполезна. Это заставляет некоторых ученых поставить под сомнение теорию эволюции в целом. Но стоит начать разбираться, и выясняется, что эти системы на самом деле не являются «несократимо сложными». Удаление некоторых деталей не уничтожает молекулярную машину, а лишь снижает ее эффективность. Значит, в прошлом могла существовать машина без этой детали, а деталь присоединилась позже, что повысило эффективность работы. Но даже если удаление детали делает молекулярную машину нефункциональной, это может быть результатом долгой взаимной «притирки» деталей. Необходимо также помнить, что организму, не имеющему какой-то молекулярной машины, будет полезен даже очень простой, малоэффективный, едва работающий ее вариант».
Для передвижения в жидкой среде некоторые бактерии используют вращающийся жгутик, который приводится микроскопическим электродвигателем, собранным из нескольких белковых молекул. Раскручиваясь до 1000 об/мин, жгутик может толкать бактерию вперед с необыкновенно большой скоростью — 100−150 мкм/с. За секунду одноклеточное перемещается на расстояние, превосходящее его длину более чем в 50 раз. Если это перевести на привычные нам величины, то спортсмен-пловец ростом в 180 см должен был бы переплывать 50-метровый бассейн за полсекунды!
Метаболизм бактерии устроен таким образом, что положительные ионы водорода (протоны) накапливаются между внутренней и внешней мембранами ее клетки. Создается электрохимический потенциал, увлекающий протоны из межмембранного пространства в клетку. Этот поток протонов проходит через «двигатель», приводя его в движение.
Нанороботы внутри нас

Встречаются наивные люди, утверждающие, что за миллиарды лет эволюции природа так и не изобрела колесо. Если бы они уменьшились до наноуровня и совершили путешествие внутрь живой клетки, то увидели бы не только колесо, но и электродвигатели, конвейеры, сборочные линии и даже шагающих роботов.
По подсчетам биологов, в живой клетке функционирует около сорока известных науке молекулярных машин. Они возят грузы по молекулярным «рельсам», выступают в качестве «включателей» и «выключателей» химических процессов. Машины из молекул производят энергию для поддержания жизни, сокращают наши мышцы и строят другие молекулярные машины. А еще они вдохновляют ученых на строительство рукотворных нанороботов, которые в будущем смогут жить и работать во внутриклеточном мире.
Чтобы представить себе, из чего и как ученые-гулливеры будут строить роботов-лилипутов, мы рассмотрели несколько наномашин, созданных самой природой.
Экспертное мнение
Александр Марков,
биолог, популяризатор науки, профессор МГУ:
В ходе эволюции очень легко возникают системы, выглядящие на первый взгляд «несократимо сложными». Они состоят из многих частей, которые приносят пользу только все вместе, убери одну — и вся система перестает работать, а каждая отдельная часть сама по себе вроде бы бесполезна. Это заставляет некоторых ученых поставить под сомнение теорию эволюции в целом. Но стоит начать разбираться, и выясняется, что эти системы на самом деле не являются «несократимо сложными». Удаление некоторых деталей не уничтожает молекулярную машину, а лишь снижает ее эффективность. Значит, в прошлом могла существовать машина без этой детали, а деталь присоединилась позже, что повысило эффективность работы. Но даже если удаление детали делает молекулярную машину нефункциональной, это может быть результатом долгой взаимной «притирки» деталей. Необходимо также помнить, что организму, не имеющему какой-то молекулярной машины, будет полезен даже очень простой, малоэффективный, едва работающий ее вариант.
Жгутик бактерии

Схема «электродвигателя» бактерии гораздо больше напоминает инженерный чертеж, чем изображение живого организма. Главная деталь «мотора» — белок Mot A с ионными каналами, благодаря которым поток протонов заставляет ротор вращаться, как турбина
Для передвижения в жидкой среде некоторые бактерии используют вращающийся жгутик, который приводится микроскопическим электродвигателем, собранным из нескольких белковых молекул. Раскручиваясь до 1000 об/мин, жгутик может толкать бактерию вперед с необыкновенно большой скоростью — 100–150 мкм/с. За секунду одноклеточное перемещается на расстояние, превосходящее его длину более чем в 50 раз. Если это перевести на привычные нам величины, то спортсмен-пловец ростом в 180 см должен был бы переплывать 50-метровый бассейн за полсекунды!
Метаболизм бактерии устроен таким образом, что положительные ионы водорода (протоны) накапливаются между внутренней и внешней мембранами ее клетки. Создается электрохимический потенциал, увлекающий протоны из межмембранного пространства в клетку. Этот поток протонов проходит через «двигатель», приводя его в движение.
Белковую структуру «мотора» называют комплексом Mot, который, в свою очередь, состоит из белков Mot A (статора) и Mot B (ротора). Ионные каналы в них расположены таким образом, что движение протонов заставляет ротор вращаться подобно турбине. Манипулируя структурой белка, некоторые бактерии умеют изменять направление и скорость движения, а иногда даже включать «задний ход».
Наличие вращающихся частей у живого организма поначалу казалось столь невероятным, что потребовало серьезных экспериментальных подтверждений. Таких подтверждений было получено несколько. Так, в лаборатории академика Скулачёва бактерию характерной формы (в виде полумесяца, где передняя часть бактерии была вогнутой, задняя — выпуклой) прикрепляли жгутиком к стеклу и наблюдали за ней в микроскоп. Было хорошо видно, как бактерия вращается, постоянно показывая наблюдателю лишь переднюю часть, свою «впалую грудь», и никогда не поворачиваясь «спиной».
АТФ-синтаза
Протонная АТФ-синтаза — самый маленький в живой природе биологический мотор шириной всего в 10 нм. С его помощью живые организмы вырабатывают аденозинтрифосфат (АТФ) — вещество, которое служит основным источником энергии в клетке.
АТФ состоит из аденозина (соединение хорошо знакомого нам по ДНК азотистого основания аденина и сахара рибозы) и трех последовательно подсоединенных к нему фосфатных групп. Химические связи между фосфатными группами очень сильные и содержат много энергии. Эта консервированная энергия может пригодиться для питания самых разнообразных биохимических реакций. Однако сперва необходимо определенным образом приложить энергию, чтобы упаковать аденозин и фосфатные группы в молекулу АТФ. Этим и занимается АТФ-синтаза.
Поступающие в организм жирные кислоты и глюкоза проходят многочисленные циклы, в процессе которых специальные ферменты дыхательной цепи откачивают положительные ионы водорода (протоны) в межмембранное пространство. Там протоны накапливаются, как войско перед битвой. Создается потенциал: электрический (положительные заряды снаружи митохондриальной мембраны, отрицательные внутри органеллы) и химический (возникает разница концентраций ионов водорода: внутри митохондрии их меньше, снаружи больше).
Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм.
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию. Они проходят по специальным каналам в АТФ-синтазе, которая встроена во внутреннюю сторону мембраны. Поток протонов раскручивает ротор, будто река водяную мельницу. Ротор вращается со скоростью 300 оборотов в секунду, что сопоставимо с максимальными оборотами двигателя болида «Формулы-1».

Как и в случае со жгутиками бактерий, движение ротора АТФ-синтазы было подтверждено экспериментально: прикрепив к вращающемуся участку помеченный флуоресцирующим красителем белок актин, похожий на длинную нить, ученые своими глазами увидели, что он вращается. И это несмотря на то, что соотношение размеров у них такое, как если бы человек размахивал двухкилометровой плетью
АТФ-синтазу по форме можно сравнить с грибом, «растущим» на внутренней стороне мембраны митохондрии, при этом описанный выше ротор прячется в «грибнице». «Ножка гриба» вращается вместе с ротором, и на ее конце (внутри «шляпки») закреплено некое подобие эксцентрика. Неподвижная «шляпка» условно делится на три дольки, каждая из которых деформируется, сжимается при прохождении эксцентрика.
К «долькам» прикрепляются молекулы аденозиндифосфата (АДФ, с двумя фосфатными группами) и остатки фосфорной кислоты. В момент сжатия АДФ и фосфат прижимаются друг к другу достаточно сильно, чтобы образовать химическую связь. За один оборот «эксцентрик» деформирует три «дольки», и образуется три молекулы АТФ. Помножив это на количество секунд в сутках и примерное количество АТФ-синтаз в организме, мы получим удивительную цифру: ежедневно в человеческом теле вырабатывается примерно 50 кг АТФ.
Все тонкости этого процесса необычайно сложны и многообразны. За их расшифровку, которая потребовала почти ста лет, были вручены две Нобелевские премии — в 1978 году Питеру Митчеллу и в 1997 году Джону Уокеру и Полю Бойеру.
Кинезин
Кинезин — это линейный молекулярный мотор, передвигающийся по клетке вдоль путепроводов — полимерных нитей. Будто портовый грузчик, он перетаскивает на себе всевозможные грузы (митохондрии, лизосомы), используя в качестве топлива молекулы АТФ.
Внешне кинезин похож на сплетенного из тонких веревок игрушечного «человечка»: он состоит из двух одинаковых полипептидных цепей, верхние концы которых сплетены и соединены вместе, а нижние расставлены в стороны и имеют на концах «ботинки» — глобулярные головки размером 7,5×4,5 нм. При движении эти головки на нижних концах поочередно отрываются от полимерной «тропинки», кинезин поворачивается на 180 градусов вокруг своей оси и переставляет одну из нижних «стоп» вперед. При этом если один его конец при движении тратит энергию (молекулу АТФ), то другой в это время высвобождает компонент для образования энергии, АДФ. В итоге получается непрерывный цикл подачи и траты энергии для полезной работы.

Кинезин, шагая по «тропинкам» из микротрубок, переносит различные грузы в клетке
Как показали исследования, кинезин способен довольно бодро вышагивать по клетке своими «веревочными» ножками: делая шаг длиной всего 8 нм, за секунду он перемещается на гигантское по клеточным меркам расстояние в 800 нм, то есть делает 100 шагов в секунду. Попробуйте представить себе такие скорости в человеческом мире!
Искусственные наномашины
Человеком, который подтолкнул научный мир к созданию нанороботов на основе биологических молекулярных устройств, стал выдающийся ученый-физик, нобелевский лауреат Ричард Фейнман. Его лекцию 1959 года с символичным названием «Там внизу еще много места» биоинженеры всего мира считают отправной точкой в этом нелегком деле.
Прорыв, позволивший перейти от теории к практике, случился в начале 1990-х годов. Тогда английские ученые из Университета Шеффилда, Фрэйзер Стоддарт и Нил Спенсер, и их итальянский коллега Пьер Анелли сделали первый молекулярный челнок — синтетическое устройство, в котором происходит пространственное перемещение молекул. Для его создания используют ротаксан — искусственное вещество, в котором кольцевая молекула (кольцо) нанизана на линейную молекулу (ось). Отсюда и название вещества: лат. rota — колесо и axis — ось. Ось в ротаксане имеет форму гантели, чтобы с помощью объемных групп на концах не позволять кольцу соскальзывать со стержня.
Челнок на основе ротаксана перемещает кольцевую молекулу вдоль линейной, на которой она держится, с помощью протонов (ослабляя или увеличивая водородные связи, удерживающие по центру кольцевую молекулу) и броуновского движения, толкающего вперед кольцо. Это похоже на брошенный в ручей резиновый мячик, привязанный к веревке: ослабили веревку (водородные связи) и стремительный ручей (броуновское движение) подхватит мяч и увлечет его вперед. Натянули веревку — мяч возвратится назад.
В 2010 году группа американских биоинженеров, Милан Стоянович и его коллеги, создали молекулярного наноробота, способного перемещаться по ДНК. В ходе эксперимента ученые смогли проследить, как их наноробот смог самостоятельно сделать 50 шагов и передвинуться на 100 нм. Робот, внешне напоминающий паука, может автономно выполнять несколько команд: «идти», «повернуть», «остановиться». По мнению авторов, он очень востребован в медицине в качестве доставщика лекарств в клетку.
«Наномашина» — это «четырехколесная» молекула, созданная в 2005 году группой под руководством профессора Джеймса Тура (Университет Райса). Собственного мотора у нее нет, однако при нагревании поверхности до порядка 200°C фуллереновые колеса начинают вращаться, и машинка катится
В 2013 году английские и шотландские биоинженеры под руководством Дэвида Лея смогли создать первый в мире молекулярный наноконвейер: наномашину, способную собирать пептиды, короткие белки. В природе эту задачу выполняют рибосомы — органеллы, находящиеся в наших клетках. Биоинженеры взяли за основу для своей машины молекулу ротаксана и на ее «стержне» смогли собрать из отдельных аминокислот белок заданного свойства. Правда, в соревновании с природной сборкой белков в рибосоме искусственная молекулярная машина пока проигрывает: ей понадобилось 12 часов на присоединение каждого аминокислотного остатка, в то время как рибосомы справляются с этой задачей быстрее чем за секунду.
Несмотря на это, исследователи с оптимизмом рассматривают свою разработку. «Вы получаете машину, которая точно движется, поднимает молекулярные строительные блоки и ставит их вместе. Если природа делает это, почему не можем мы?» — отметил профессор Лей.
Молекулярные машины: от создания искусственной модели к терапии рака
Твое будущее в его руках ©
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Для развития загадочного мира ДНК-технологий ученые черпали идеи своих изобретений, по-видимому, из мира научной фантастики, которые превратились из литературного вымысла в новую реальность. Пожалуй, именно поэтому при упоминании термина «наномашины», у большинства людей возникают образы серебристых микроскопических роботов с искусственным интеллектом. В фантастических романах они обычно пытаются подчинить человечество или наносят ущерб всему, с чем сталкиваются. Наши же ДНК-нанороботы вовсе не обладают такими ужасающими способностями. Более того, благодаря стремительному развитию нанотехнологий машины на основе ДНК обладают высоким потенциалом для терапии смертельных заболеваний. Однако можно ли их применять в реальных условиях человеческого организма? А главное, насколько эффективно применение ДНК-нанороботов в нашей жизни? На эти и многие другие вопросы вы найдете ответы в данной статье. Более того, статья расскажет читателям о последних разработках индустрии нанотехнологий и перспективах создания врачей-роботов будущего.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Почему рак, а не лобстер?
Рак как болезнь куда старше человечества: он известен у динозавров, живших в мезозойской эре примерно 240 млн лет назад [1]. Где возникает многоклеточная форма жизни, существует и шанс, что механизм управления клетками выйдет из строя и приведет к неконтролируемому росту и делению клеток. Подобный процесс был обнаружен и выделен в качестве отдельной болезни еще древними людьми [2].
Доподлинно известно, что греческий врач Гиппократ первым обнаружил у пациента опухоль, по форме напоминающую краба, впоследствии римский врач Авл Корнелий Цельс в I в. до н. э. перевел греческое слово καρκίνος на латынь (cancer — рак) [3], [4]. Можете себе представить, что первые методы лечения рака были особенно фантастическими: аптекари того времени запасались зубом кабана, легкими лисиц, настойками свинца, молотым белым кораллом и другими столь же нерезультативными средствами, в то время как хирурги иногда проводили подобие мастэктомии без анестезии в антисанитарных условиях [5], [6].
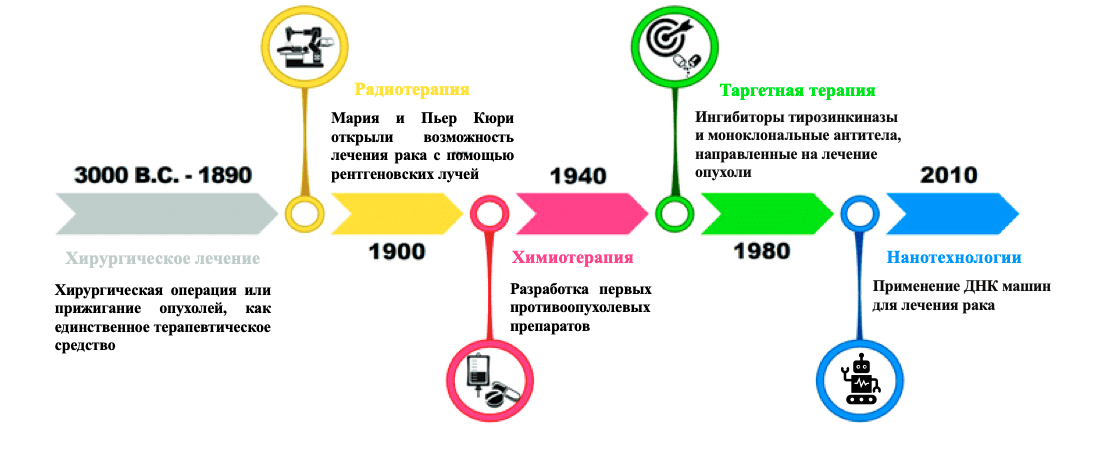
В конце XIX века ученые обратили внимание на возможность убивать злокачественные клетки с помощью лучевой терапии, несмотря на пагубное влияние излучения на здоровые ткани организма. Однако медицина идет вперед (рис. 1), некоторые виды рака уже излечимы в большинстве клинических случаев, благодаря созданию новейших препаратов и переходам к нестандартным методам лечения.
Рисунок 1. Хронология внедрения новых методов лечения злокачественных опухолей. После развития лучевой терапии в начале 1900 года, начался современный этап онкологии с появлением первых химиотерапевтических препаратов примерно в 1940 году. Впоследствии произошел прорыв в области медицинской онкологии с развитием таргетной терапии в 1980 году, что определило улучшение эффективности лечения рака. Последний поворот произошел в 2010 году с появлением ДНК наномашин, ведущих борьбу с биомаркерами раковых клеток.
Например, большинство таргетных препаратов, которые успешно спасают жизни, направлены на белки. В основе целевой, или таргетной (англ. target — цель, мишень), терапии злокачественных опухолей лежит точечное воздействие на характерные молекулы, располагающиеся на поверхности клетки, транслирующие информационные сигналы напрямую в клеточное ядро.
Возникновение опухоли — это процесс накопления мутаций (ошибочных сигналов) под действием различных внешних и внутриклеточных факторов в клеточном геноме. Чем дольше происходит деление поврежденных клеток, тем выше вероятность злокачественного перерождения клетки под действием канцерогенов. Как результат — опухоль дает рецидив в связи с накоплением таких повреждений.
Наравне с таргетными лекарствами развивались прочие многообещающие механизмы борьбы с измененными клетками. Так, методы, основанные на нуклеиновых кислотах, давно привлекают внимание исследователей в качестве регуляторов канцерогенеза на молекулярном уровне.
В начале нашего тысячелетия ученые обратили внимание на особое направление лечения онкозаболеваний — метод генетических модификаций, нацеленный на подавление развития рака путем снижения экспрессии генов, участвующих в развитии онкологических заболеваний. Это становится возможным за счет использования технологий антисмысловых олигонуклеотидов, РНК-интерференции, рибозимов и/или дезоксирибозимов и CRISPR/Cas9. Большинство известных подходов не исключает пагубного влияния не только на раковые, но и на здоровые клетки, а также характеризуется низкой эффективностью, в связи с чем становится невозможным повсеместное уничтожение раковых клеток [7]. Альтернативой традиционным экспериментальным подходам к лечению онкологических заболеваний служат собранные ДНК-наномашины.
Словарик
Составные части ДНК-наномашин
Окей, Google. Что такое ДНК-наномашины?
Наноархитекторы строят структуры ДНК, двигатели и цепи, используя тот же основной принцип, что и природа. Особенность сборки таких устройств заключается в способности нуклеиновых кислот образовывать двойную спираль в строго определенной конформации в соответствии с правилом комплементарности. Таким образом, различные последовательности ДНК могут быть запрограммированы на самосборку, компоновку друг с другом для формирования разнообразных 2D- и 3D-структур.
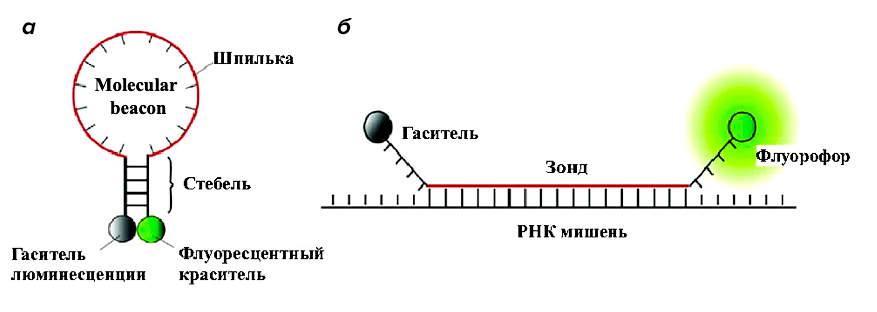
Самый простой пример создания конструкций на основе нуклеиновых кислот — это так называемые «молекулярные маяки» (molecular beacon, MB). Они представляют собой последовательности олигонуклеотидов в виде шпильки (рис. 2а), несущие флуорофор на одном из концов и гаситель флуоресценции на другом. В отсутствие мишени молекулярный маяк находится в стабильной шпильке, за счет чего флуорофор и гаситель пространственно сближены, соответственно, свечение отсутствует. При взаимодействии зонда с целевой мишенью образуется их комплекс, благодаря чему изменяется конформация зонда, и флуорофор отдаляется от гасителя, что приводит к появлению сигнала флуоресценции (рис. 2б).
Рисунок 2. Принцип работы молекулярного маяка
Появление в 1996 году такого молекулярного инструмента, как молекулярный зонд-маяк [8], [9] стало предпосылкой к созданию первых ДНК-машин [7], [10].
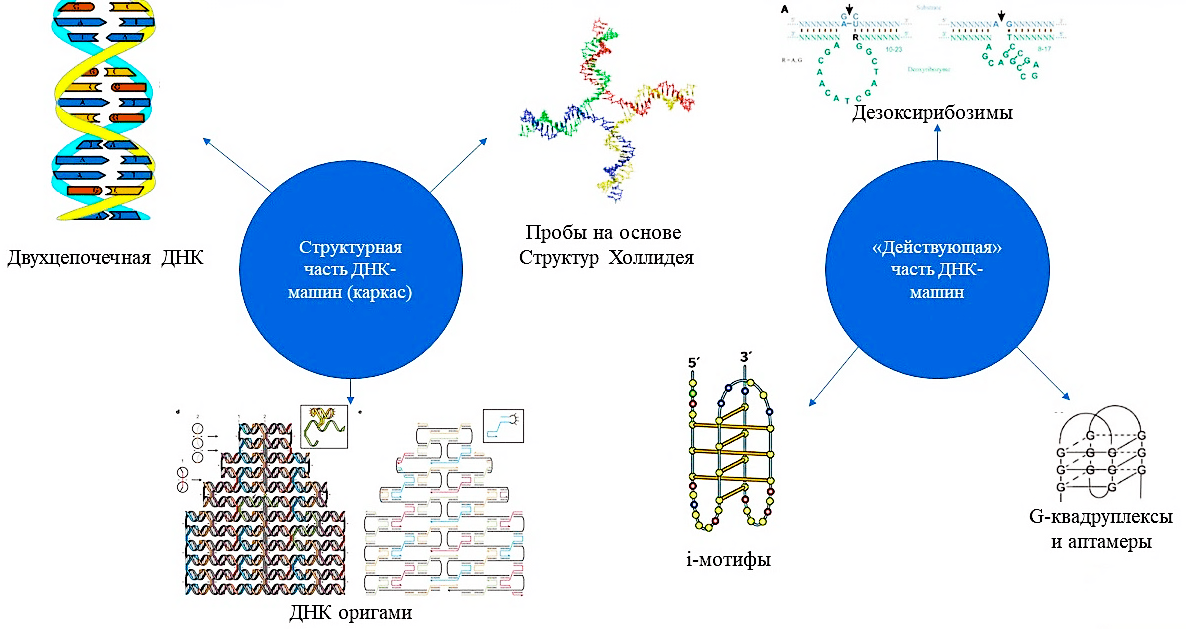
Последние 20 лет развития ДНК-технологий привели к синтезу большого количества различных ДНК-конструкций, структурными элементами которых выступают обычные двухцепочечные ДНК, структуры Холлидея, ДНК-оригами, а в качестве действующих частей могут быть i-мотивы, аптамеры и G-квадруплексы, а также дезоксирибозимы (рис. 3). Структурные части ДНК-машин служат их каркасом, к которому присоединяются функциональные, активные части ДНК-машин, которые открывают большой потенциал для их использования в диагностике (рис. 6), доставке лекарственных молекул (рис. 4) и генной терапии (рис. 8).
Рисунок 3. Схематичное представление различных составных частей ДНК-наномашин
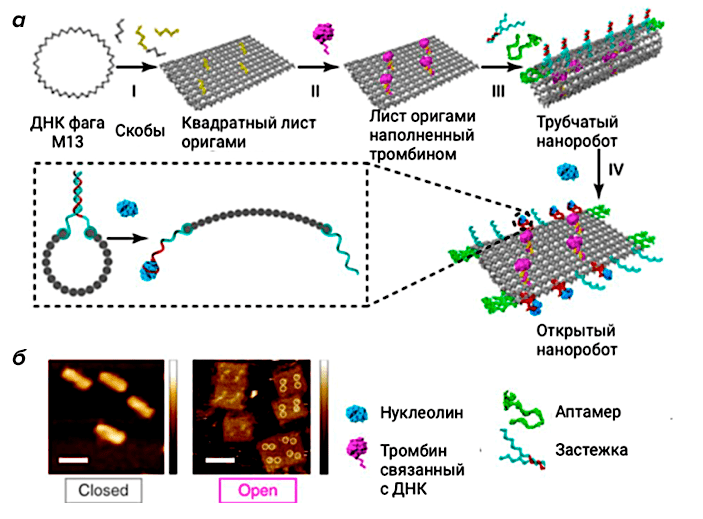
Один из самых известных ДНК-нанороботов создан группой китайских ученых на основе методов ДНК-оригами и ДНК-аптамеров (рис. 4). Их конструкция позволила доставить тромбин — фермент, отвечающий за свертывание крови, — заключенный в трубчатую конструкцию ДНК-оригами, непосредственно в раковые клетки за счет использования ДНК-структур (аптамеров), которые раскручивали ДНК-робота только в присутствии особых белков, специфичных для раковых клеток. Именно этот фермент послужил основным орудием наноробота, который стимулировал свертывание крови внутри кровеносных сосудов и заблокировал кровоток, что в свою очередь привело к смерти тканей опухоли [11].
Рисунок 4. Схематичное изображение ДНК-наноробота для доставки терапевтических молекул (тромбина) в раковые клетки. а — Конструкция и механизм работы ДНК-наноробота. б — Изображения ДНК-конструкции в закрытой и открытой конформациях, полученные при помощи атомно-силовой микроскопии.
В отличие от этой работы, другие исследования концентрируются на непосредственной способности ДНК-конструкций обеспечивать терапевтический эффект, а не только доставлять биологические агенты внутрь раковых клеток.
Терапевтическая функция ДНК-конструкций достигается за счет использования уникальных ДНК-молекул, обладающих каталитической активностью по расщеплению целевых РНК-мишеней, или иначе — дезоксирибозимов.
Дезоксирибозимы — каталитические молекулы ДНК
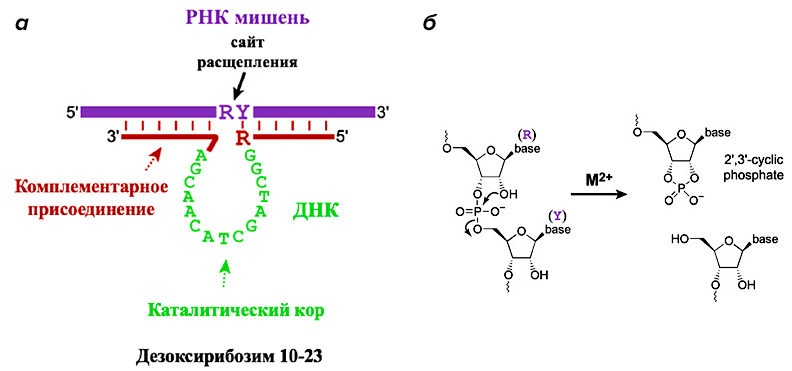
Они способны катализировать расщепление РНК за счет образования сложных структур (рис. 5) [12]. Впервые потенциал дезоксирибозимов (Dz) экспериментально продемонстрировали в 1994 году Р. Брикер и Г. Джойс [13], которые использовали селекцию in vitro (SELEX) для поиска специфичных последовательностей ДНК, способных катализировать расщепление фосфодиэфирной связи в РНК.
Рисунок 5. Работа РНК-расщепляющих дезоксирибозимов. а — Комплекс дезоксирибозима 10–23 (красного и зеленого цветов) и целевой РНК (синего цвета), образованный за счет принципа комплементарности, где R = пурин, Y = пиримидин. б — Химическая реакция расщепления РНК, где М 2+ — ион металла, необходимый для стабилизации переходного состояния.
В отличие от каталитических белков (ферментов) и рибозимов, дезоксирибозимы не обнаружены в живых клетках, и для использования в практических целях их синтезируют искусственно. Вместе с тем они обладают большей химической стабильностью по сравнению с природными рибозимами, и их синтез обходится дешевле.
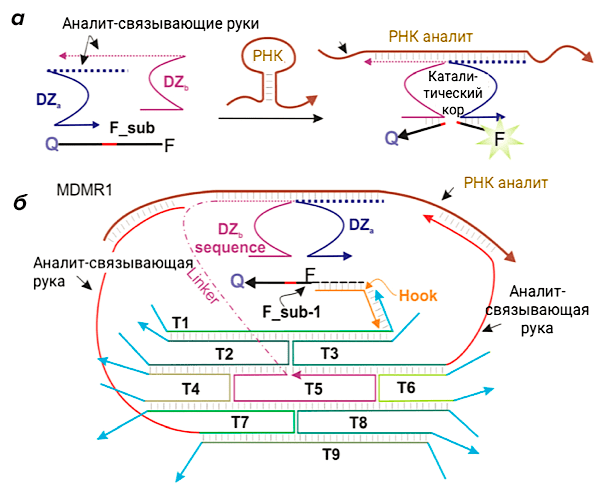
Использование дезоксирибозимов в диагностике заболеваний началось в 2008 году после создания бинарных дезоксирибозимных зондов (рис. 6а). Ранее мы описали способ обнаружения нуклеиновых кислот при помощи молекулярных маяков, но, учитывая низкую селективность в отношении появления несовпадений в последовательности и дорогостоящий синтез для новых целевых нуклеиновых кислот, данная технология требовала серьезной доработки. В результате были разработаны бинарные сплит-Dz-зонды (biDz), которые представляют собой дезоксирибозимы, разделенные на две части (DZa и DZb) [7]. Каждая их часть оборудована «руками», связывающими и расщепляющими флуоресцентный субстрат (F_sub), снабженный флуорофором и гасителем, а также фрагментом, комплементарным анализируемой ДНК или РНК. Расщепление F_sub с помощью бинарного Dz в присутствии целевой ДНК или РНК вызывает заметное увеличение флуоресценции в растворе, как в случае с молекулярным маяковым зондом [14]. Такие бинарные дезоксирибозимные зонды некоторое время применялись в диагностике. Со временем стало ясно, что их можно улучшить, включив в состав ДНК-машин (рис. 6б). Благодаря такому «апгрейду» зонд стал детектировать целевую последовательность, например, рибосомальную 16S рРНК, в концентрации почти 20 раз меньшей, чем детектировал исходный biDz.
Рисунок 6. Конструкция ДНК-наномашины MDMR1 для диагностики. а — Механизм работы бинарного дезоксирибозима. Нити ДНК DZa и DZb комплементарно связываются с фрагментами РНК-аналита и образуют каталитический кор, который позволяет расщепить субстрат, меченный флуорофором (F) и гасителем (Q), вызывая при этом в ответ на разрезание флуоресцентный сигнал. б — Конструкция машины MDMR1.
Инструкция по применению: как использовать дезоксирибозимы в ДНК-машине для терапии рака?
С точки зрения молекулярной биологии, основная причина развития рака — это необратимые нарушения в генетическом материале одной единственной клетки, которые приводят к ее бессмертию и безграничному делению. В конечном итоге накапливается большое количество «сломанных» клеток, и образуется опухоль, а в дальнейшем, если развитие заболевания не будет приостановлено, происходит и метастазирование. Сегодня известно огромное количество отличий в геномах раковых клеток от нормальных геномов. Эти отличия обеспечивают характерный для раковых клеток фенотип.
Основываясь на знаниях о геноме злокачественной опухоли, ученые неоднократно пытались применить дезоксирибозимы для расщепления матричных РНК онкогенов. Расщепление матричной РНК (мРНК) внутри живой клетки приводит к ее деградации и окончательному выключению синтеза целевого белка в соответствии с центральным правилом реализации генетической информации, из которого следует, что передача информации осуществляется от нуклеиновых кислот к белку, но не в обратном направлении.
Сегодня в литературе описано несколько десятков случаев использования расщепляющих РНК дезоксирибозимов для подавления экспрессии онкогенов [15–17]. Более того, было проведено несколько клинических испытаний дезоксирибозимов в терапии рака, как отдельно [18], так и в совокупности с лучевой терапией [19], которые показали низкую токсичность и высокую потенциальную эффективность дезоксирибозимов в терапии рака. Однако сегодня, к сожалению, неизвестно ни одного одобренного подхода терапии опухолей при помощи дезоксирибозимов. Это может быть связано с некоторыми проблемами их применения, например, с труднодоступностью целевых мРНК-мишеней в раковых клетках, ввиду их стабильной вторичной структуры, или с неспособностью этих средств полностью излечить рак. В ряде случаев подавление экспрессии онкогенов ведет лишь к подавлению роста опухоли, а не к гибели раковых клеток.
Для оптимизации лечения опухолей дезоксирибозимами перед нашей научной группой из лаборатории SCAMT (растворной химии передовых материалов и технологий) Университета ИТМО была поставлена цель создать ДНК-наномашину на основе РНК-расщепляющих дезоксирибозимов. Чтобы решить первую проблему, было достаточно добавить к дезоксирибозиму дополнительные РНК-расплетающие руки, такие же, как на рисунке 6б, и ДНК-каркас, который будет удерживать две функциональные группы вместе. Для решения второй проблемы было решено использовать в качестве мишени мРНК генов «домашнего хозяйства».
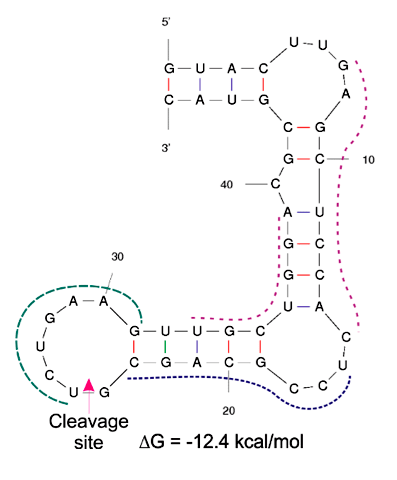
Рисунок 7. Пример вторичной структуры матричной РНК онкогена DAD1
Однако, скажете вы, нацелившись на ген «домашнего хозяйства», мы полностью лишимся избирательности метода, ведь в таком случае дезоксирибозим будет убивать все клетки на своем пути. Здесь на помощь нам пришла технология бинарных дезоксирибозимных зондов (рис. 6а), которая до этого применялась лишь в диагностике заболеваний, но ни разу не была применена в терапии. Таким образом, в качестве экспериментальной мишени мы взяли мРНК гена «домашнего хозяйства» вместо F_sub, а в качестве аналита для образования каталитического ядра избрали мРНК гена DAD1 (defender against cell death 1), отвечающего за апоптоз клетки с высоким уровнем экспрессии преимущественно в раковых клетках (рис. 7).
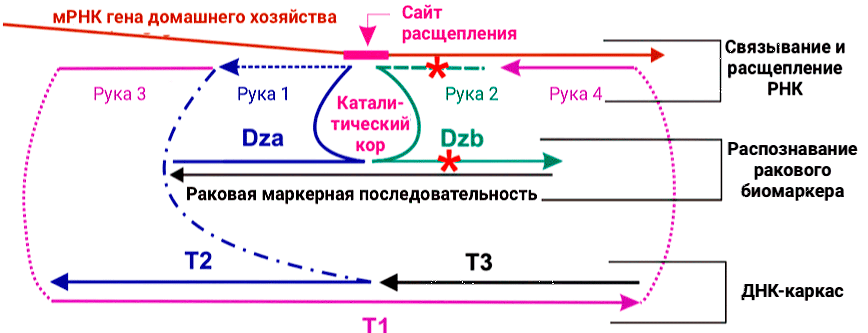
В результате была разработана ДНК-наномашина на основе бинарного дезоксирибозима DZ 10-23, разделенного на две части, благодаря чему ДНК конструкция обладала тремя основными свойствами:
Рисунок 8. Дизайн ДНК-машины для расщепления РНК-мишеней на основе biDz. Часть бинарного дезоксирибозма DZa соединена линкерами (синяя пунктирная линия) с последовательностью T2, которая связывается с последовательностями T1 и T3, которые вместе образуют ДНК-каркас, обеспечивающий стабильность всей структуры. DZb должен связываться с остальной частью ДНК-машины и расщеплять целевую мРНК гена «домашнего хозяйства» только в присутствии онкомаркера. Красные звезды показывают места несовпадений.
Стоит отметить, что разработанный подход принципиально отличается от используемой ранее дезоксирибозимной технологии, в основном за счет использования в качестве мишени мРНК гена «домашнего хозяйства». Кроме того, этот факт обеспечивает нашу ДНК-платформу широкой универсальностью применения. В будущем предложенный подход позволит применять ДНК-наномашину для лечения любого типа рака благодаря подбору новых раковых биомаркеров и адаптации конструкции для активации расщепления целевой мРНК гена «домашнего хозяйства» новой биомаркерной последовательностью.
Несмотря на ряд технических проблем, разработанный нами подход был опубликован в высокорейтинговом научном журнале, а известные масс-медиа (в том числе «РИА Новости» и «Интерфакс») опубликовали статьи о создании «нанокиллеров» раковых клеток [20–22]. Пожалуй, это произошло потому, что повышение качества и продолжительности жизни человека — ключевые факторы развития российской экономики. Для повышения эффективности профилактики, диагностики и лечения социально значимых заболеваний, а также реабилитации пациентов необходимы технологические прорывы в области биомедицины. Они прежде всего связаны с созданием принципиально новых лекарств, продуктов для клеточной и генной терапии, инструментов высокоспецифичной молекулярной диагностики.
Сегодня все наши силы направлены на то, чтобы заставить созданную ДНК-конструкцию эффективно работать в клетках. Для этого мы:
Итак, использование разработанной ДНК-наномашины может открыть новые пути для терапии раковых заболеваний. Однако для его непосредственного применения в терапии на живом организме необходимо провести значительную доработку конструкции.
Машины для проведения диагностики и тераностики заболеваний
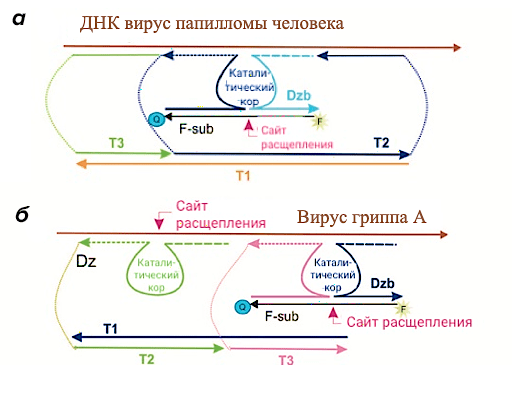
Наша научная группа занимается не только созданием ДНК-машин для терапии рака, но и созданием ДНК-конструкций, обладающих иными функциями. На рисунке 9а представлена созданная нашей научной группой ДНК-машина для диагностики вируса папилломы человека [23]. Созданная конструкция позволила детектировать ДНК вируса в пикомолярной концентрации, что существенно превышает предел обнаружения ранее разработанных подходов. Кроме того, при объединении в одной ДНК-платформе детектирующей и расщепляющей заданный участок РНК частей, открывается возможность использования ДНК-машин в терапии и диагностике различных заболеваний. Так на рисунке 9б представлена ДНК-наномашина для одновременной детекции и терапии вируса гриппа А. Результаты испытания этой ДНК-конструкции будут в ближайшее время опубликованы.
Рисунок 9. Варианты ДНК-машин для диагностики и тераностики заболеваний
To be continued.
Научные достижения сегодняшнего дня — основа для изменения привычного нам мира завтра. Мы рассмотрели современные тренды в области диагностики и динамики персонализированного лечения и представили, как они изменят мир в будущем.
Помимо того, с появлением новой стратегии в медицине — тераностики, объединяющей диагностику заболеваний и персонализированное лечение пациента с улучшенной эффективностью и безопасностью, — возникают более интенсивные подходы к исследованиям и лечению заболеваний на молекулярном уровне [14], [24–27].
Значительная часть новых ДНК-технологий еще находится на ранней стадии исследований и разработок. При этом стремительные темпы развития в направлении создания ДНК-наномашин, подобных разработанной нами конструкции, позволяют надеяться на скорое внедрение лекарств на основе таких наномашин в практическую медицину.